文献解读(3)在AML中是否存在RNA剪切差异?
看教程不够直观,那就看视频吧! >>点击加载视频
点击"生信学霸"添加关注,我们一起进步
RNA splicing alterations induce a cellular stress response associated with poor prognosis in Acute Myeloid Leukemia
RNA剪切改变诱导急性髓性白血病预后不良的细胞应激反应
发表期刊:Clinical Cancer Research
发表日期:2020 Mar 2.
影响因子:8.91
DOI: 10.1158/1078-0432.CCR-20-0184
01—
研究背景
世界范围内,肺癌是死亡率较高的癌症之一,其中肺腺癌(LUAD)是主要的分子亚型。尽管在过去十年中对LUAD的分子机制和临床管理有了很大的提高,如小分子抑制剂如酪氨酸激酶抑制剂(TKIs)可显着改善患者预后,但是通过靶向药物治疗会使患者产生异质性反应和耐药性。
RNA剪切是一个从有限的基因集合中产生蛋白质多样性的基本生物学过程。剪切因子基因的复发性体细胞突变在某些血液系统癌症中很常见,但在急性髓细胞性白血病中相对罕见(AML,<20%的患者)。
02—
材料和方法
患者队列
在研究的发现阶段,作者使用了两个成人AML队列的数据:TCGA-AML队列和Clinseq-AML队列。作者应用Beat-AML队列的数据来验证splicing signature的重要性。
RNA-seq数据分析
使用自定义的内部生物信息学流程,结合可用的工具(包括MISO)分析多类型选择性剪切的RNA序列数据,以确定每个样本中的剪切百分比(PSI)值和rMATS以进行差异剪切分析。使用DESeq2进行差异基因表达分析。开发了一个定制的内部流程,以识别由于差异剪切事件而引起的带注释的蛋白质结构域的可能变化。使用rMAPS可以预测RNA结合蛋白的差异结合。用MaxEntScan进行最大熵建模。
预后模型建立
使用LASSO-Cox回归法生成splicing signature,在R包glmnet进行十倍交叉验证。根据回归系数计算每个患者的剪切风险得分。通过Harrel的C指数评估了预后模型的效果并评估了所有预后模型的风险贡献和变量重要性。
03—结果展示
1. 识别与AML患者预后相关的差异性可变剪切
作者使用广泛使用的ELN预后方案对TCGA-AML患者进行分层(图1A),并只对接受化疗且可获得完整临床数据的患者进行分析(n = 104)。在ELN Fav和ELN Adv之间进行差异剪切分析(图1B),研究了五种不同类型的可变剪切事件(图1C),在910个基因中鉴定了1288个差异剪切事件(FDR≤0.05)(图1D)。结果显示大多数事件优先涉及一组患者外显子的差异性跳跃(或保留)(n=716,图1D)。差异外显子用法的一个例子是在TCGA-ELN Fav患者中跳过MYO9B的第37外显子(图1E)。在ELN Fav患者中仅检测到第36外显子至第38外显子的读数(图1E)。一个相互排斥的外显子使用的相关现象(交替使用相邻的外显子)促成了185个差异事件(图1D)。内含子的保留是TCGA-ELN Adv患者中次高流行的类别(n = 201,图1D),如CDK10中内含子8保留的代表性例子所示(内含子特异性读数增加,ELN Adv患者的外显子-外显子读数减少, 图1F)。
为了验证这些发现,作者分析了来自Clinseq研究的一个独立的AML患者队列。选择与TCGA队列相似的患者,作者在Clinseq-ELN Fav(n = 47)和ELN Adv(n = 75)患者之间进行了差异剪切分析(图1G)。结果作者共检测到2484个可变剪切事件,影响了1566个基因(图1H)。与TCGA队列一样,Clinseq数据中的大多数事件是跳过的外显子(n=1217,图1H)。互斥的外显子使用是第二普遍的(n=854),其次是内含子保留(n=232,图1H)。比较两个队列,作者发现差异剪切事件发生在同一方向,即在这两个队列的ELN Adv患者或两个队列的ELN Fav患者中都富集了222个基因(图1I)。
在这两个队列中,有93个剪切事件(在78个基因中)相同,将其定义为A类事件。第二类是B类,影响相同的基因,具有相同的方向性,但代表不同的剪切事件,或发生在两个队列的基因内的不同位置。在19个基因中,作者观察到两个队列之间的剪切方向相反。为了确定这种选择性剪切的分子影响,作者进行了通路分析。对A类和B类基因的通路表明,富集了许多通路,包括那些与蛋白质翻译或细胞内信号转导功能相关的通路(图1J)。这些数据显示,在两个独立的队列中,预后好或差的AML患者之间的复发性和共有性可变剪切差异集中在特定的分子通路上。
2. 预测可变剪切的功能结果
与基因突变类似,作者认为尽管某些剪切事件可能对后续的蛋白质翻译产生潜在的有害影响,但其他事件可能会保持沉默。为了识别有害的剪接事件,作者开发了一个自定义的生物信息学流程。简要地说,每个剪切事件的染色体坐标用于产生剪切和未剪切转录本的核苷酸序列。然后将它们进行计算机翻译,并扫描产生的一级序列以预测蛋白质的作用(图2A)。使用这种方法,作者预测26%的A类和B类事件(n = 87,图2B)会导致完整注释的蛋白结构域完全丢失。这些事件大多数涉及改变阅读框的内含子保留事件(图2B,2C)。另外20%的事件(n = 67)导致蛋白质结构域的部分丢失(图2B)。作者关注于导致完全结构域丢失的事件,通路分析显示,受异常剪切影响的蛋白质仍然富集特定的分子功能,包括先前观察到的蛋白质翻译(图2D)。这些结果表明,在AML患者中经常发生可变剪切变化,导致参与蛋白质翻译的基因中预期的蛋白质功能障碍。
3. 可变剪切差异的上游驱动因素分析
接下来,作者试图了解这些风险组中剪切差异的根本原因。作者根据患者的A类和B类事件的相似性对患者进行聚类,并评估聚类中体细胞突变的富集性(图2E)。除了ELN分类算法固有的NPM1,TP53和CEBPA突变外,没有其他体细胞突变显示与剪切组有任何统计显著相关性(图2E)。
在可变剪切的基因中,有RNA结合蛋白,包括在RNA剪接中具有已知作用的因子(图3A)。这些因子与多个已知的蛋白质-蛋白质相互作用形成紧密互连的网络(图3B),表明这些因子的错配可能触发AML患者的一系列剪切改变。ELN Adv患者的外显子包含率较高,在转录本中通常会结合并抑制剪切(图3C)。与非差异剪接外显子的背景设置相比,ELN Fav AML患者差异保留的八十七个外显子两侧的HNRNPC结合基序显著富集(图3D )。这些结果进一步扩展了作者对差异剪接序列决定因素的分析,与非差异剪切外显子的背景集合相比,ELNAdv患者中与差异剪切外显子相邻的供体(图3E)和受体剪接位点处非标准碱基的使用增加。与背景外显子相比,ELNAdv患者(n = 87)差异跳过的外显子也具有较弱的剪接供体位点(图3F)。
4. 在ELN Adv AML患者中诱导综合应激反应
蛋白质翻译受损的细胞后果将是诱导细胞内的综合应激反应(ISR)。为了找到支持这一点的证据,作者在ELN Fav和ELN Adv患者之间进行了差异基因表达分析(图4A)。结果显示TCGA中有2219个基因差异表达(图4B),在Clinseq中,有1710个基因差异表达(图4B)。对差异表达基因进行GSEA分析显示,在这两个队列中,ELN Adv AML患者中ISR基因上调(图4C)。此外,单个患者分析显示,诱导ISR基因表达的强度与同一患者内蛋白质翻译基因错配的程度成正比(图4D)。ELNAdv患者ISR靶基因的表达水平较高,其蛋白质翻译基因的错配水平较高(图4D)。
在这两个队列中以相同方向差异表达的602个基因的通路分析表明,许多炎症相关通路的富集(图4E)。作者发现这些应激诱导的炎症基因在ELN Adv AML患者中上调,其中蛋白质翻译因剪切而受到影响(图4F)。网络分析进一步证实了错配的翻译相关基因与ELN Adv AML中差异表达的促炎基因之间的紧密联系(图4G)。这些数据支持以下情形:蛋白质翻译基因的错配会触发ELN Adv患者的促炎性应激反应。
5. 确定可变剪切的预后相关性
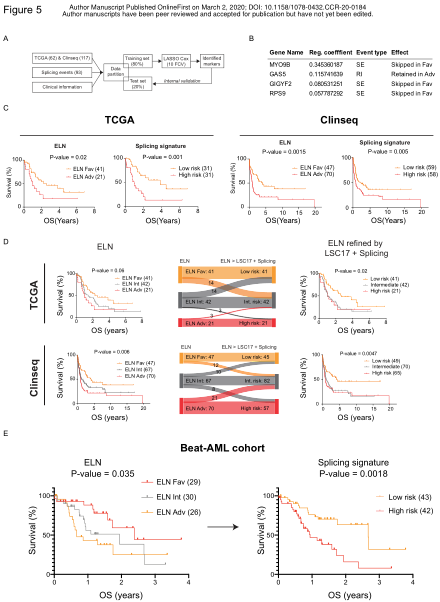
基于这些发现,作者探究了可变剪切是否可以作为AML不良结局的预后指标。利用机器学习技术(图5A),作者鉴定了四个基因(MYO9B,GAS5,GIGYF2,RPS9,图5B),它们的差异性可变剪切可以将预后良好和不良的AML患者分层。在这两个队列中,这四个基因的差异剪切(“splicing signature”)的表现与ELN相当(图5C)。由于基于突变和细胞遗传学的ELN,基于基因表达的LSC17 signature和上文的的splicing signaure代表了互补的生物学测量结果,因此,作者研究了它们的组合潜力,可以更准确地对AML患者进行分类。将这三个特征结合起来应用,提高了AML患者分类的准确性,将三组风险分类转化为两个队列中总体生存率显著不同的两组(图5D)。
为了独立验证splicing signature的预后意义,作者还分析了来自BEAT-AML队列的数据。选择TCGA和Clinseq队列的患者,根据转录组数据进行RNA剪切分析,并计算剪接风险评分。在该独立患者组中,splicing signature的预后意义优于ELN(图5E)。
04—
结果图
图1 在AML患者数据集中筛选差异可变剪接
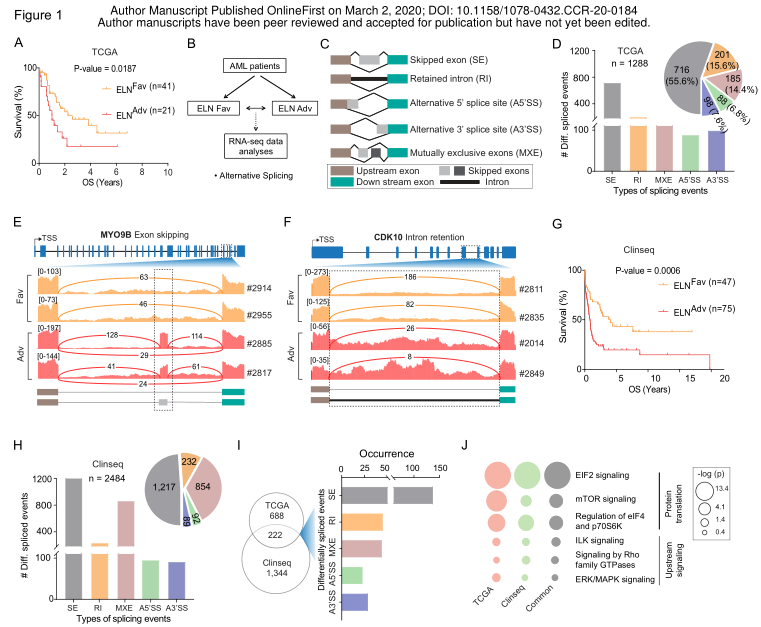
图2分析可变剪接对预测蛋白质功能影响
图3差异可变剪接的上游调控因子的影响

图4 可变剪切对基因转录的影响
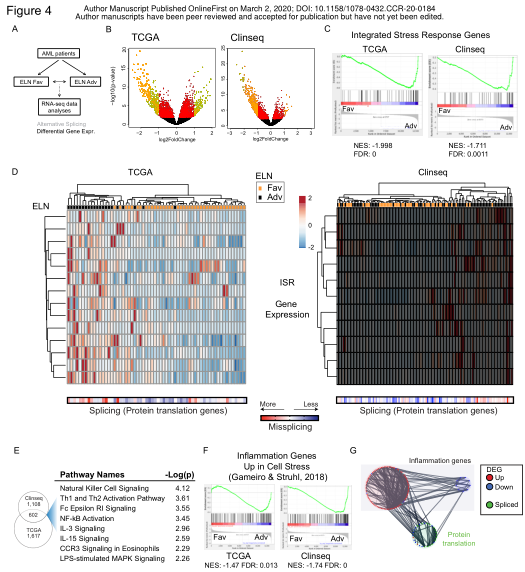
图5 可变剪切对AML患者预后的影响

- 发表于 2020-06-15 15:51
- 阅读 ( 7682 )
- 分类:文献解读
你可能感兴趣的文章
- 文献分享(2)患者的生存期和对精准免疫治疗反应的影响 3893 浏览
- 文献解读(1)MiRNA表达模式与肺腺癌的肿瘤突变负担相关? 5520 浏览
