文章分享(二)不同的肿瘤微环境中,缺氧及免疫与预后关系
看教程不够直观,那就看视频吧! >>点击加载视频
在不同的肿瘤环境中,肿瘤内缺氧和免疫与患者预后有关。然而,由于缺乏有效的生物标志物,这些因素目前还没有被考虑用于头颈部癌症(HNC)的治疗中。在此,为大家介绍一篇发在Clinical cancer research上的关于预后相关低氧免疫分类器的文献【Development and Validation of a Combined Hypoxia and Immune Prognostic Classifier for Head and Neck Cancer 2019.6 IF:9.619 】


1. 基于文献挖掘得到54个缺氧免疫相关的signature基因
2. 分析TCGA中HNC数据集的表达谱,以及两个独立的验证集
3. 用免疫组化研究蛋白signature
4. 采用多重免疫荧光染色法观察缺氧和免疫markers的空间分布
文章用到的数据信息如表1所示
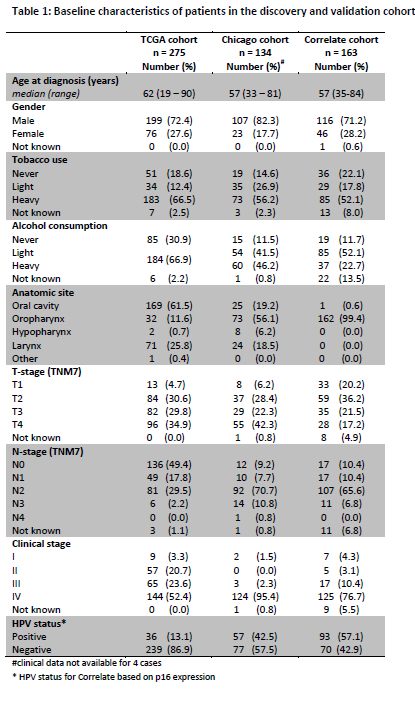 表1
表1

1. 预后分类器的开发
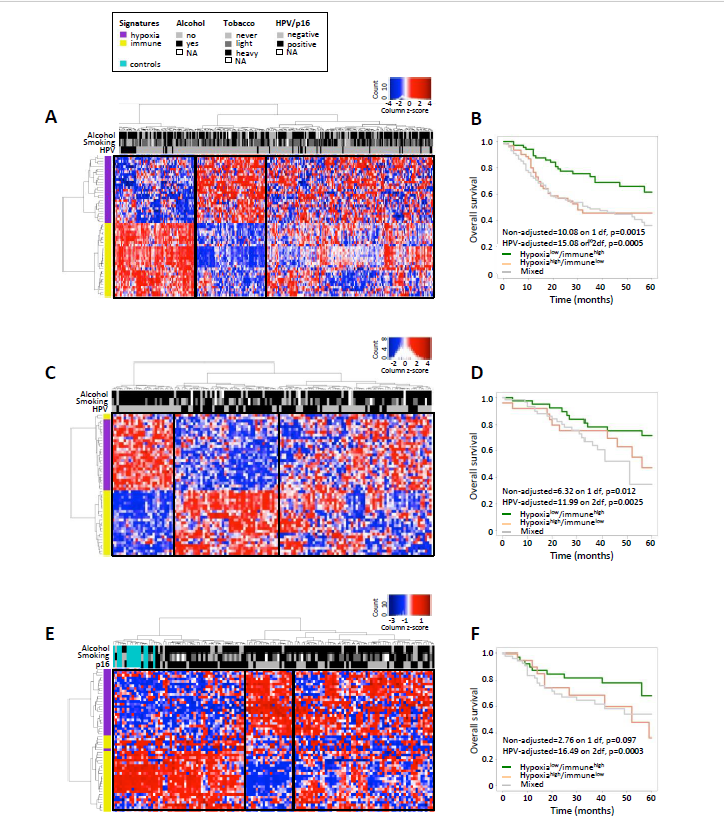 图1
图1
在第一部分,作者首先在TCGA中得到275个头颈癌样本,使用先前得到的两个缺氧以及免疫相关的signature基因集,得到这些基因的表达谱,然后使用无监督的二维层次聚类,可以看到如图1A所示,样本被清晰的分成了3个不同亚组。然后对这个亚组进行生存分析,生存分析结果如图1B所示。其中hypoxialow/immunehig组的预后最好。
2. 对预后分类进行验证
在这一部分,作者使用两套验证集数据对先前得到的缺氧免疫亚组进行验证,验证结果分别如图1C-F所示,通过对验证结果的观察可以发现,在这两套验证集数据中,与之前结果相似,都是hypoxialow/immunehig亚组的预后最好,所以在这一部分可以看出,之前得到的缺氧免疫signature的准确性。
3. 刻画每个缺氧免疫相关基因在三个亚组中的表达分布
 图2
图2
在这一部分作者主要想探究缺氧免疫相关的基因在这些亚组中的分布情况,如图2所示,缺氧相关的基因在每个亚组中具有很高的交集,尤其是hypoxiahigh/immunelow组和混合组,然而,有一部分基因展示出了较大的表达差异,如CA9, SLC2A1 (GLUT1) 和SLC16A1 (MCT1),如图2上半部分所示。进一步也可以观察到,CIRC signature所刻画的免疫应答相关基因均有差异表达,但表达程度不同,表达顺序为:低氧/高免疫>混合>低氧/低免疫。
4.蛋白表达分类器
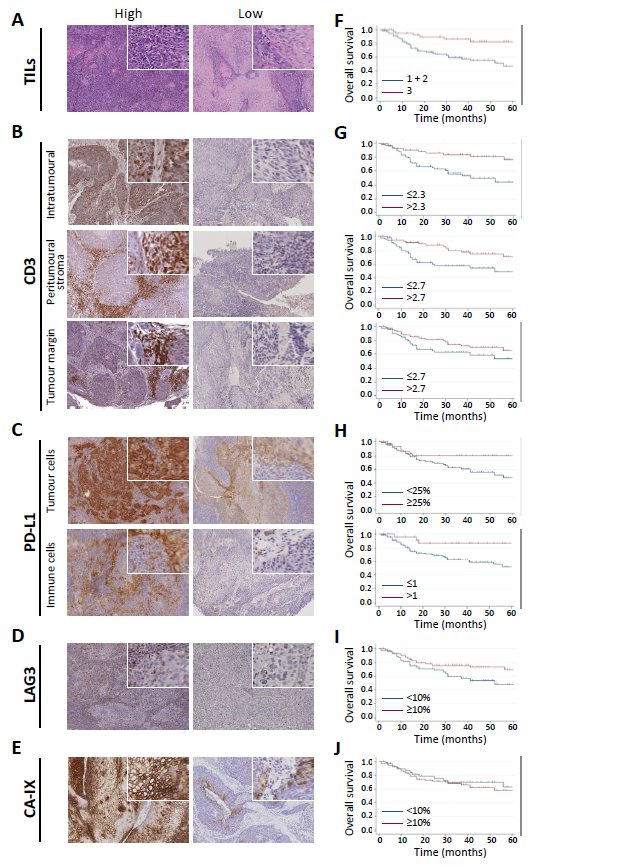 图3
图3
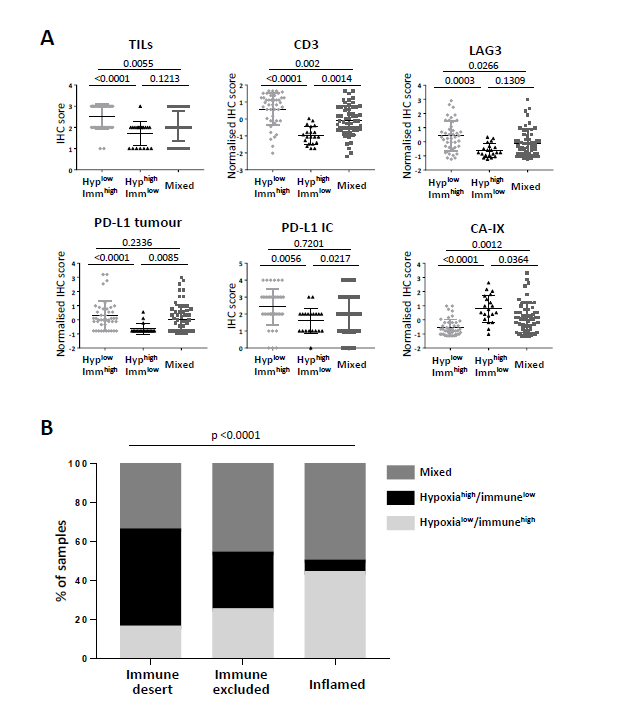 图4
图4
在这一部分作者认为虽然基因signature可能更好地反映免疫细胞与低氧肿瘤微环境之间的复杂相互作用,但简化的免疫组化标记可能更具有临床应用价值。如图3展示了不同的表达模式以及与OS的关系。其中图3A展示了TILs数目的高低,图3B展示了CD3在肿瘤的不同区域的情况,图3C构建PD-L1在肿瘤微环境中的表达模式,图3D展示了LAG3在在浸润免疫细胞中的表达情况。图3E则展示了CA-IX在肿瘤细胞内的表达情况,图F-J则是对应的生存曲线。而图4则对这些marker在三类亚型中情况进行了整体的刻画。
5. 免疫谱系
在这一部分作者说明,根据T细胞在肿瘤和微环境中的频率和分布,包括HNC在内的癌症可以被分为三种免疫类型。为了探索肿瘤免疫谱与上述三个基因定义亚组之间潜在的联系。所有样本基于CD3染色的量级和模式赋予免疫表型(desert/excluded/inflamed),如图4B所示,可以看出hypoxiahigh/immunelow 过多出现在 ‘immune desert’ 表型并且在炎症亚群中显著降低。而在 hypoxialow/immunehigh的模式正好相反 ,进一步发现混合型肿瘤在这三类证都存在。
6. 刻画肿瘤微环境中免疫细胞与缺氧的空间互作
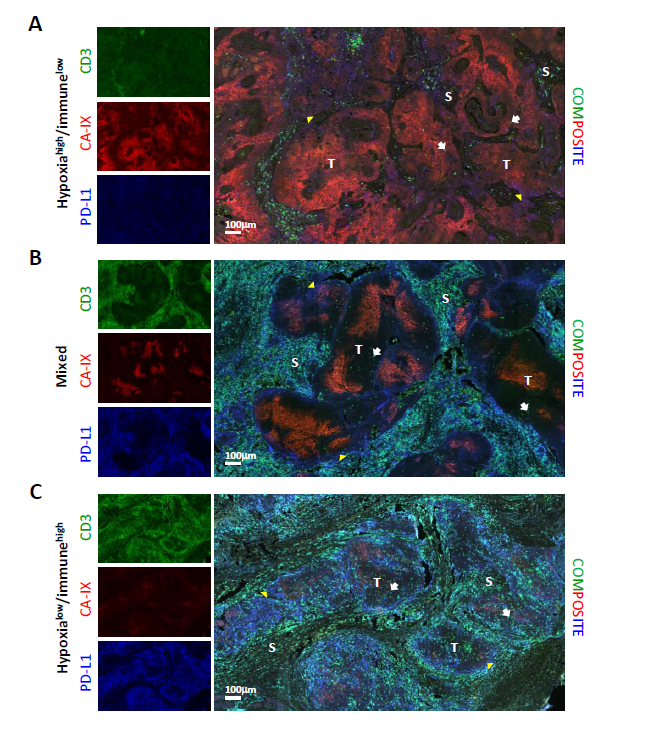
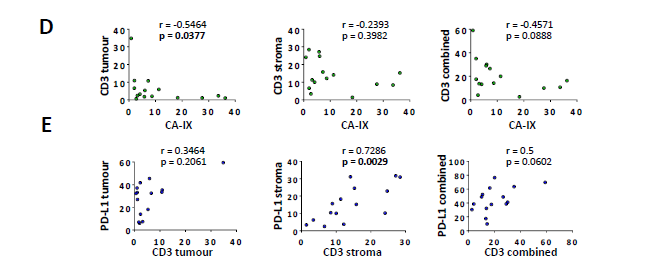 图5
图5
在最后的一系列分析中,作者主要观察了肿瘤微环境中不同细胞亚群的空间分布情况。尤其是在肿瘤中缺氧与免疫细胞位置以及PD-L1表达之间的关系。采用Opal多重免疫组化染色法对上面得到的低氧免疫亚群中的15例样本进行了分析。具有代表性的图像如图5所示。可以观察到高水平CA-IX表达的肿瘤亚群显示出“免疫沙漠”表型,在基质细胞或肿瘤间室中几乎没有T细胞(图5A),在其他病例中,在瘤周基质中观察到大量的T细胞,但很少有细胞浸润到肿瘤巢中,这与“免疫排斥”表型一致(图5B),最后一类包括“炎症性”肿瘤,瘤周基质中存在大量T细胞,瘤内浸润明显,尤其是在无缺氧的情况下(图5C)。总的来说,我们观察到肿瘤巢内CA-IX阳性与CD3+ T细胞的患病率呈显著的负相关(图5D左)但不单独存在于间质部分(图5D中)以及肿瘤环境(图5D右)。间质PD-L1与CD3 T细胞的负相关符合IFNγ-mediated表达的主导作用(图5E)。
这篇文章就介绍到这里,可以看到作者将生物信息学方法与免疫组化相结合得到了缺氧免疫相关的预后signature,研究的方法与角度是不是值得借鉴呢。

文章分享(三)iCCA的亚型与基因组、表观组、预后以及细胞来源的差异的关系
- 发表于 2019-07-25 10:49
- 阅读 ( 6465 )
- 分类:文献解读
