文章分享(一)What?肿瘤纯度是一个潜在的关键因素
看教程不够直观,那就看视频吧! >>点击加载视频
胶质瘤中肿瘤纯度是一个潜在的关键因素
今天要和大家分享的是2017年10月发表在Clinical cancer research上的一篇关于胶质瘤中肿瘤纯度的文献【Tumor Purity as an Underlying Key Factor in Glioma IF:9.619】
在胶质瘤组织中不仅仅只包含胶质瘤细胞,也存在与胶质瘤相关的非肿瘤细胞,如基质细胞以及免疫细胞。这些非肿瘤细胞稀释了胶质瘤细胞的纯度,并且在胶质瘤的生物学过程中起到重要作用,但是胶质瘤纯度变化的影响仍不是十分清楚,这篇文章旨在研究这个问题。
数据:来自五个队列的2249个胶质瘤以及29个正常脑组织包括:
1. 训练集:
1) CGGA的RNAseq数据
2) TCGA-RNAseq数据
2. 验证集:
1) TCGA-microarray 数据集
2) REMBRANDT 数据集
3) CGGA的组织数据

1. 胶质瘤纯度与临床以及分子特征之间的关系
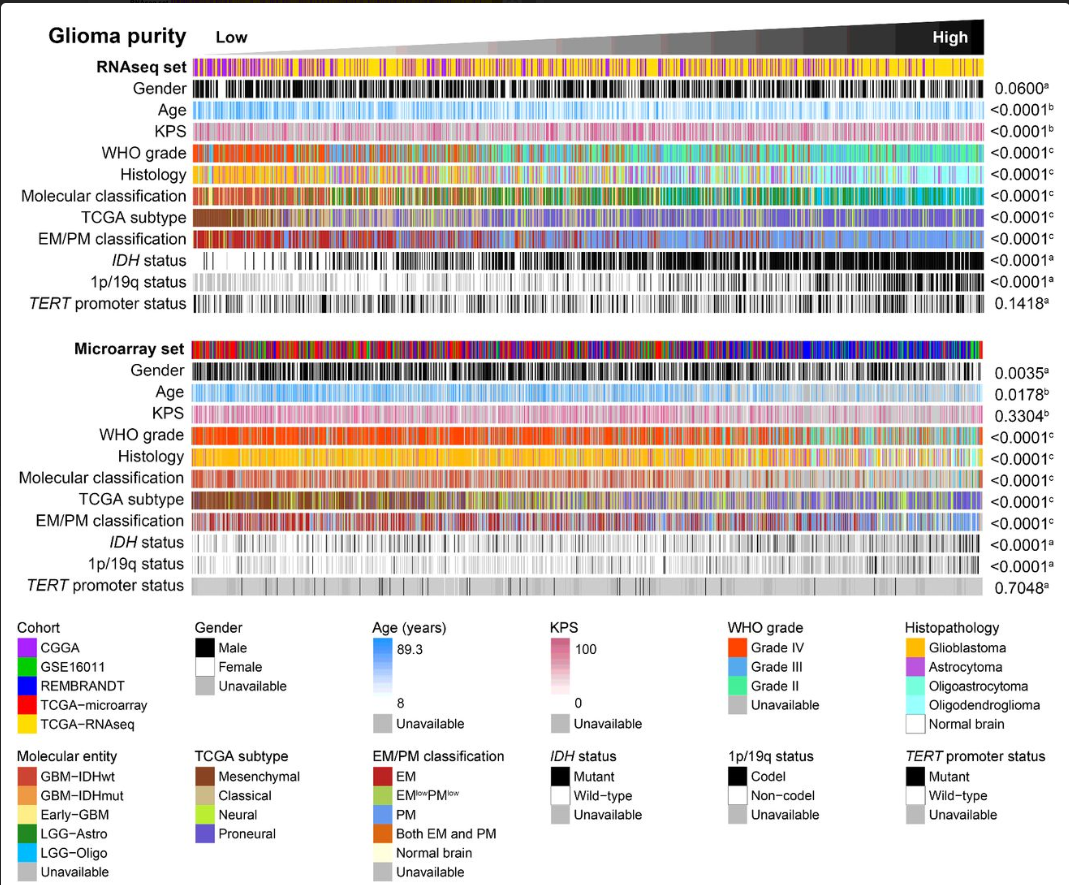 图1
图1
首先作者对胶质瘤的纯度与临床和分子特征之间的关系进行了详细的刻画,在这一部分作者用ESTIMATE评估胶质瘤纯度以及基质和免疫得分。来自 RNAseq以及微阵列的胶质瘤数据集按纯度增加的顺序排列(图1)。接着评估纯度的组间分布以及其与其他因素之间的关系。
可以发现胶质瘤纯度与诊断年龄之间呈负相关。并且低纯度的胶质瘤更可能属于间质和EM亚型,相反的,高纯度的更倾向于富集到前神经和PM亚型。在基因组改变方面,IDH突变和1p/19q共缺失出现在纯度较高的胶质瘤中。TERT启动子突变在LGGs中纯度较低,而其影响在胶质母细胞瘤(GBM)中被消除。此外,作者还观察了了纯度与其他参数在组织分层病理学和分子分类中的相关性。
2.进展的胶质瘤具有高间质及免疫得分以及低纯度的特征
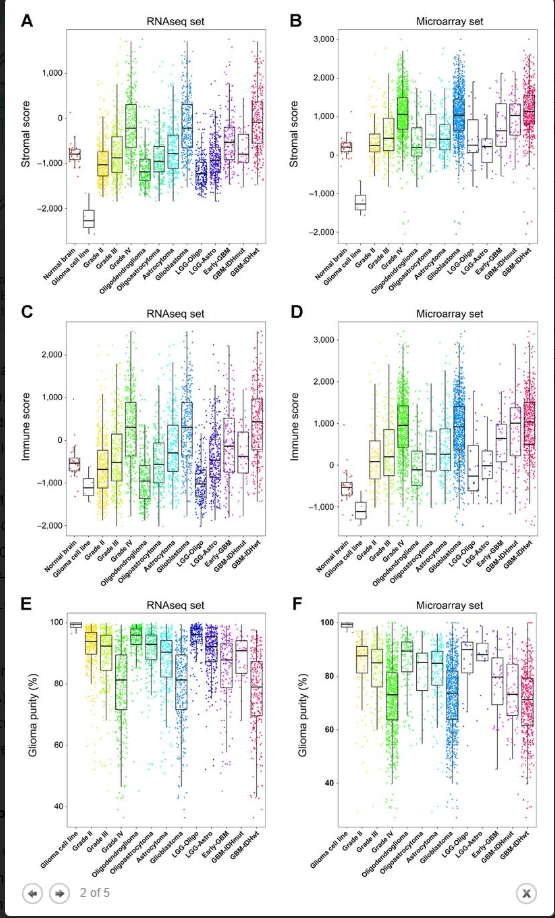 图2
图2
在这一部分,作者首先根据WHO分级系统和组织遗传学特征,将胶质瘤进行划分。间质和免疫评分随着恶性肿瘤的进展而显著升高,而胶质瘤纯度在较高级别时降低(图2)。可以看出在组织病理学分类方面,少突胶质细胞瘤的间质和免疫评分最低,但纯度最高。与此相反,GBM具有较高的间质和免疫评分,但纯度较低。在这里,作者将神经胶质瘤分为五类,包括低级别胶质瘤LGG-Oligo(是具有IDH突变的 LGG,并且TERT启动子突变或1p / 19q共缺失),LGG-Astro(是具有IDH突变的LGG并且没有TERT启动子突变或1p / 19q 共缺失),早期GBM(具有野生型IDH的LGG),GBM-IDHmut(具有突变IDH的GBM)和GBM-IDHwt(具有野生型IDH的GBM)。作者发现LGG-Oligo,LGG-Astro,Early-GBM,GBM-IDHmut和GBM-IDHwt的生存时间以这个顺序显着降低。与生存变化相一致的,可以观察到GBM-IDHwt组间质和免疫评分最高,LGG-Oligo组的最低(图2A-D)。胶质瘤纯度在LGG-Oligo组最高,GBM-IDHwt组最低(图2E和F)。
3.胶质瘤纯度低与不良预后有关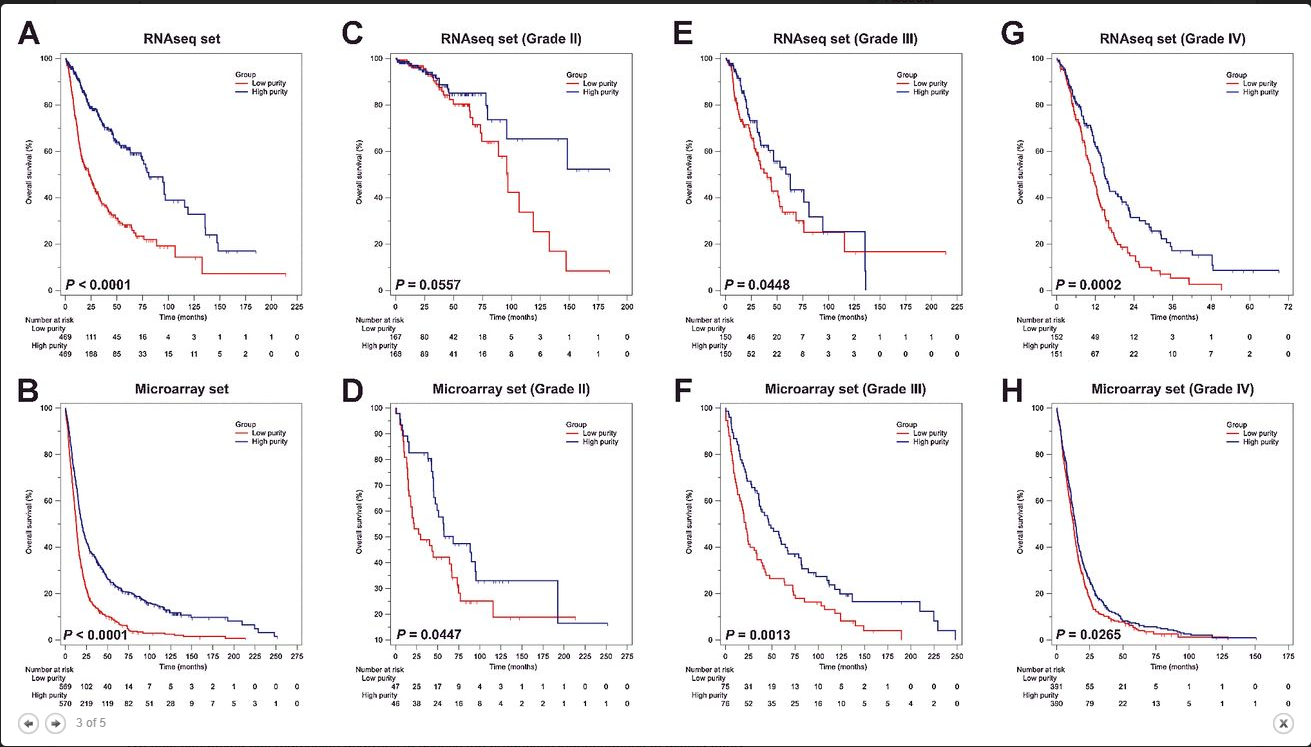
图3
在这一部分作者以中值划分样本来绘制生存曲线。对RNAseq和微阵列数据进行了并行分析。观察到低纯度样本的OS普遍比那些高纯度低(图3 A和B)。分层分析表明,除了RNAseq数据集中的二级以外,在大多数的WHO分级中低纯度具有低OS(图3 C-H)。同样在不同亚型如复发性神经胶质瘤中绘制生存曲线。尽管一些检验没有达到统计学意义,但低纯度仍然展示出大多数亚型和复发性胶质瘤预后较差的趋势。此外,对基质和免疫得分也进行了类似的分析发现他们为预后不良指标。
4.胶质瘤的纯度与不同的基因组改变模式有关
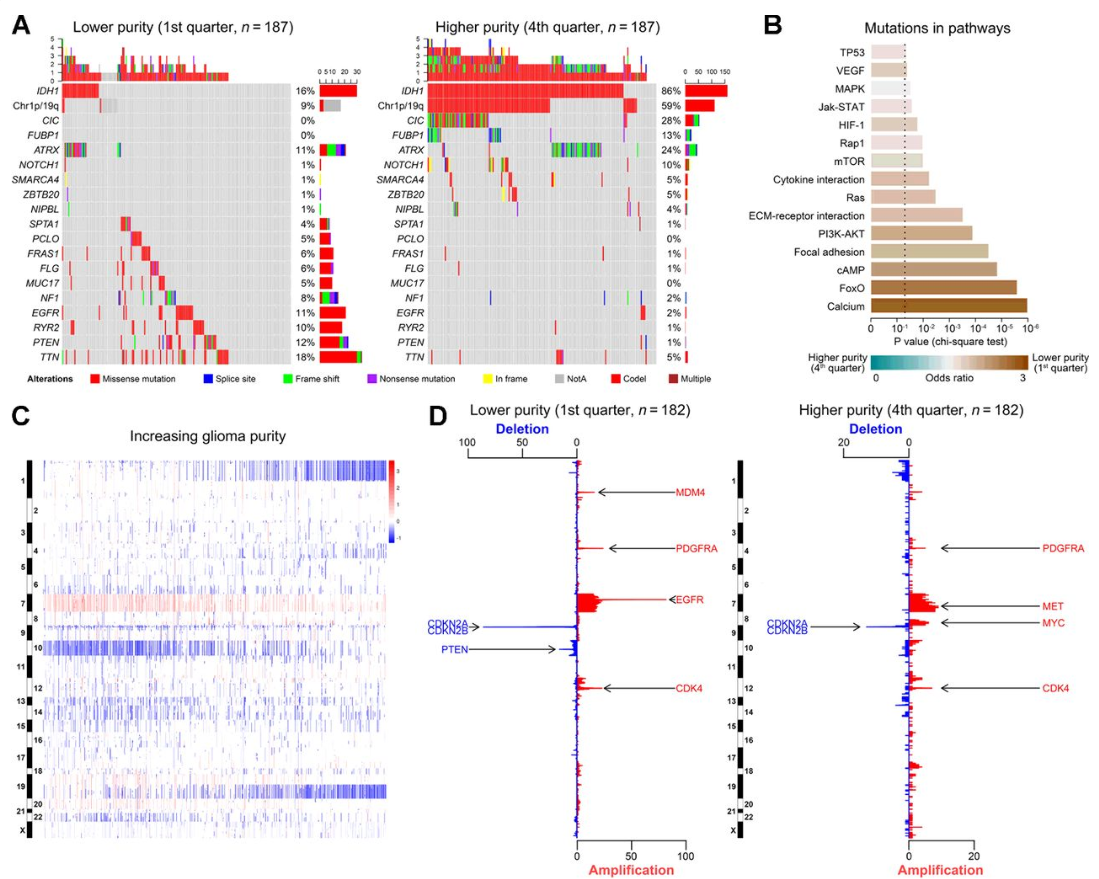 图4
图4
为了揭示影响胶质瘤内肿瘤纯度的分子机制,作者对存在突变以及CNA信息的TCGA病例进行了分析。作者发现在体细胞突变以及肿瘤纯度之间存在负相关。根据纯度的增加,将样本分为两组、三组、四组。在每一组中都进行了平行分析,以增强研究结果的可信度。作者发现四分具有代表性。首先,比较了低纯度和高纯度样本之间的突变频率,在纯度较低的病例中检测到更多的体细胞突变。在纯度较高的病例中,IDH1、CIC、FUBP1、NOTCH1的频繁突变以及1p/19q共缺失显著富集,另一方面,在纯度较低的胶质瘤中,PTEN、EGFR和NF1的突变更为频繁(图4A)。作者还观察到,TTN、PCLO、MUC17、ZBTB20、NIPBL、FRAS1和SPTA1的突变频率明显不同,这与不同的纯度有关,而现有的研究几乎没有探索它们在胶质瘤中的作用。接下来,在KEGG的基础上进一步探索基因组突变。与上述结果一致,低纯度样本在32个代表性通路中存在更多突变(图4B)。随后,对CNA数据进行了研究,发现低纯度和高纯度胶质瘤之间存在明显的染色体改变模式。CNAs与纯度呈负相关(图4C)。接下来一共鉴定出808个属于不同胶质瘤纯度具有不同突变频率的基因。所有这些差异的改变都发生在纯度较低的亚群中。在纯度较低的病例中,常被删除的基因组区域为包含CDKN2A/CDKN2B位点的9p21.3,以及包含PTEN位点的10q23.3。另一方面,与低纯度相关的最常见的扩增区域是包含EGFR的7p11.2。在低纯度胶质瘤中,CDK4和PDGFRA扩增也更频繁(图4D)。
5.低纯度的胶质瘤表现出强烈的免疫表型
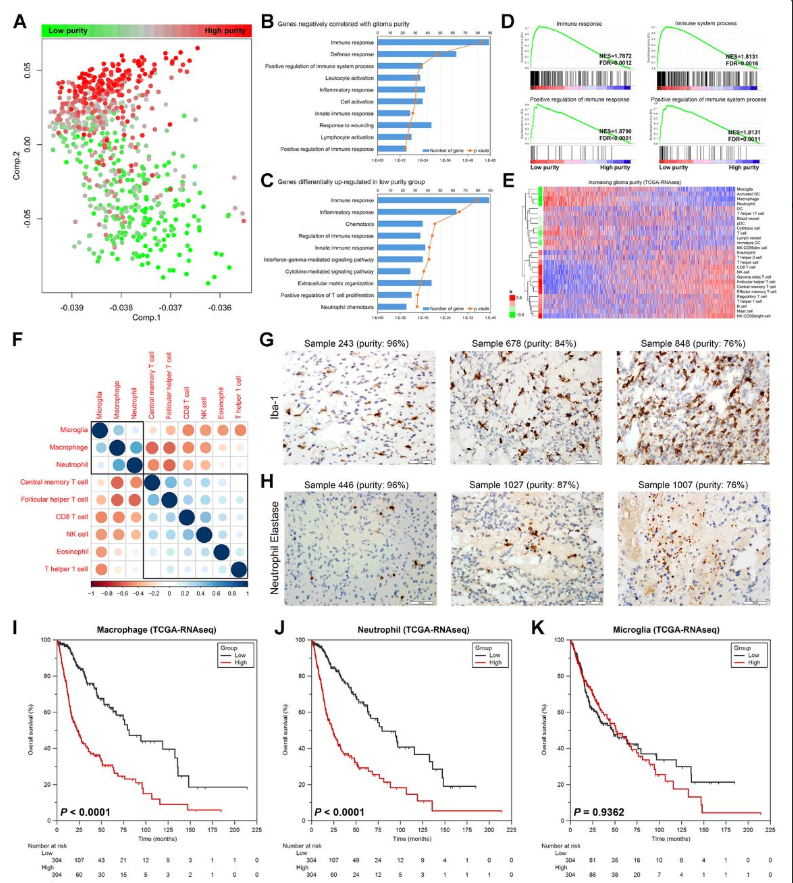 图5
图5
分析基因表达数据来探索胶质瘤纯度与生物学表型的关系。选择TCGA-RNAseq队列作为发现集,并使用其他队列进行验证。作者采用PCA来探索与胶质瘤纯度相关的转录组特征。在这里,可以观察到整个转录组表达谱与胶质瘤纯度之间存在紧密联系(图5A),揭示不同肿瘤细胞百分比一般具有不同的生物学表型。随后,作者试图找出在低纯度胶质瘤中显著增强的生物学特征进行了spearman相关分析,以确定与胶质瘤纯度相关的基因。对表达与纯度负相关最显著的基因进行GO分析,显著最富集的生物学意义大多与免疫相关(图5B)。同时,根据中位纯度将病例分为高纯度组和低纯度组。SAM被用来鉴别高纯度和低纯度样本之间的差异基因。在低纯度的样本中,差异上调的基因显著富集到免疫相关的通路(图5C)。GSEA进一步证实,不同纯度的胶质瘤患者表现出不同的免疫状态,低纯度的胶质瘤较高纯度的胶质瘤免疫表型增强(图5D)。
6.低纯度胶质瘤中巨噬细胞和中性粒细胞增多预后差
由于较低的纯度意味着较强的局部免疫状态,作者试图研究来自非肿瘤部分的哪种类型的免疫细胞增强了免疫反应。作者使用GSVA估计多个免疫细胞的signature,并将signature与胶质瘤纯度进行关联(图5E)。根据与胶质瘤纯度的关联性,免疫细胞可分为两个亚群。(图5F)。作者进一步从CGGA队列中收集了43个组织。免疫组化分析证实,在低纯度的病例中巨噬细胞/小胶质细胞和中性粒细胞的数量增加(图5和H),并与胶质瘤纯度呈不同的相关性。因此,巨噬细胞、小胶质细胞和中性粒细胞可能是一群在低纯度胶质瘤的非肿瘤部分中起作用的免疫细胞。作者进一步试图研究它们对预后的影响。生存分析显示巨噬细胞和中性粒细胞(而非小胶质细胞)与胶质瘤预后显著相关(图5I K)。

文章分享(三)iCCA的亚型与基因组、表观组、预后以及细胞来源的差异的关系
文章分享(四)CT基因的表达与癌症的亚型、分子机制、调控以及预后之间的关系
文章分享(六)膀胱癌特异性基因组改变,M2可能是巨噬细胞浸润的重要驱动因素?
文章分享(七)m1A甲基化酶基因竟与mTOR存在可靠的联系?
- 发表于 2019-07-25 10:07
- 阅读 ( 9333 )
- 分类:文献解读
你可能感兴趣的文章
- 文献解读(5)具有丰富瘤内CD103+CD8 + T细胞的胃癌免疫原性亚型的鉴定和验证 10283 浏览
- 文献解析(7)胶质瘤MR预测IDH 5005 浏览
- 文献分享(4)联合抑制PD-L2和TGF-β2可能会提高免疫治疗的效果? 4120 浏览
- 文献分享(1)肿瘤细胞和正常细胞之间mRNA丰度的关联 6836 浏览
- 文章分享(七)m1A甲基化酶基因竟与mTOR存在可靠的联系? 4914 浏览
