文献解读(2)基于MRI的放射学模型可在术前预测肝细胞癌患者的5年生存率
看教程不够直观,那就看视频吧! >>点击加载视频

复发是切除的肝癌患者死亡的主要原因。然而目前没有一个标准的方法来评估预后,那么今天小编给大家介绍的这篇文章就是关于这个的,其发表在British Journal of Cancer上,影响因子5.416。

(1)患者:这项研究是在两个医学中心进行的:北京大学肿瘤医院和中国人民解放军总医院第五医学中心。从2010年8月至2016年9月,对经手术切除,经病理证实的HCC患者进行了筛查。纳入标准如下:(1)治愈性肝切除术,定义为完全切除所有的肉眼可见肿瘤,(2)无淋巴结转移或肝外转移,(3)无大血管侵犯,(4)接受了术前对比增强MRI检查的患者,(5)没有新辅助治疗或辅助治疗,(6)术后随访了至少5年(除非死亡)。研究招募过程如图1所示
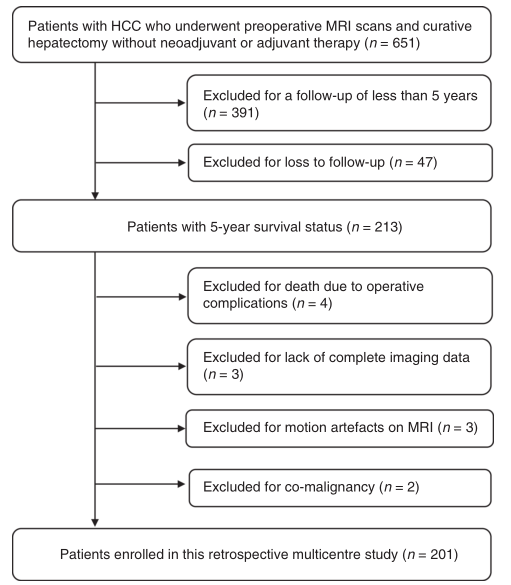
(2)Follow-up:根据AFP水平和影像学检查,所有患者术后均每3至6个月进行一次随访。根据肝内或肝外新肿瘤的影像学证据确定肿瘤复发。五年生存状态定义为术后5年生存或死亡。
(3)MRI:手术前2周内进行了MRI扫描。
(4)统计学分析:进行单变量和多变量logistic回归分析以鉴定与5年生存率相关的独立临床危险因素。单因素分析的候选因素是年龄,性别,HBsAg / HCV-ab状态,肝硬化,AFP,ALT,AST,TB,DB,ALB,PLT,PT,Child–Pugh级,MRI报告的肿瘤数,MRI-报告肿瘤大小和BCLC分期。计算风险比以及95%置信区间。使用五倍交叉验证进行稳健估计。使用SPSS 23.0版进行卡方检验,Fisher精确检验和logistic回归分析。使用Precision Medicine Open Platform版本2.0.1执对感兴趣区域(ROI)进行分割,MRI归一化和特征提取。使用Pycharm进行特征选择和模型构建。
(5)ROI分割:T1WI,T2WI,DWI和DCEI被导出为医学数字成像和通信(DICOM)文件。ROI表示的是每个切片中的所有肿瘤区域,由放射肿瘤学进行半自动分割并检查。
(6)MRI归一化和放射学特征提取:由于MRI检查是在不同的中心进行的,并且扫描仪之间存在一定的不均匀性,因此作者进行了MRI信号强度归一化以校正扫描仪的效果。从T1WI,T2WI,DWI和DCEI中自动提取了ROI。接下来进行三维重建,并将ROI图像重新采样为1×1×1mm的像素大小,这可以纠正像素间距差异并恢复肿瘤体积。提取了四组成像特征:(1)540个定向梯度特征直方图,(2)42个纹理特征,(3)48个小波特征和(4)156个统计特征。最后一组包含每个序列的786个特征,因此每位患者总共3144个特征。所有特征均以三维肿瘤体积计算。
(7)特征选择和放射学signature构建:应用随机森林算法中的基尼系数来选择与生存最相关的特征,并基于选定的特征,使用随机森林方法开发了放射性标记。
(8)放射学模型的开发和评估:使用随机森林方法构建了结合了放射学特征和独立的临床危险因素的个体化放射学模型。该模型的评估包括鉴别,校准和临床实用性。根据ROC曲线的曲线下面积(AUC)量化识别性能。根据校准曲线中预测的5年生存率与实际5年生存率之间的一致性来评估校准性能。研究流程如图2所示。
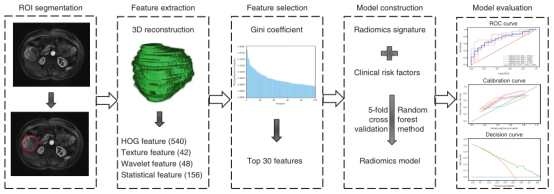 图2. 本研究中必要步骤的工作流程
图2. 本研究中必要步骤的工作流程

1. 临床特征:
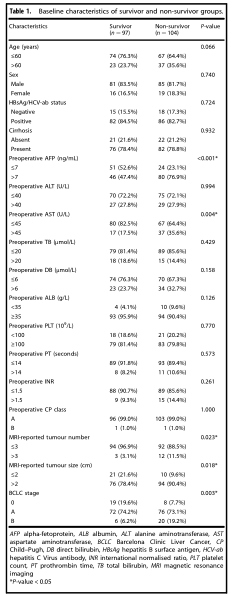
本研究共分析了201例HCC患者。168例患者感染了乙型肝炎/丙型肝炎病毒,其中149例(88.7%)定期接受抗病毒治疗。158名患者(78.6%)有肝硬化病史。中位随访时间为52.5个月(范围5.2-93.1个月)。术后5年内有97例患者存活5年以上,其中104例死亡。术后5年内,有68名存活患者没有HCC。104名非幸存者全部都经历了肿瘤复发和与肿瘤相关的死亡。133例患者发现肿瘤复发。其中101例(75.9%)患者出现肝内复发。复发后的治疗包括经动脉化学栓塞(n = 72),手术(n = 4),射频消融(n = 10),放疗(n = 2),索拉非尼(n = 20),化学疗法(n = 2)和 保守治疗(n = 23)。根据患者的5年生存状态,将其分为幸存者(n = 97)和非幸存者(n = 104)组。表1总结了两组患者的临床特征。两组之间的AFP,AST,MRI报告的肿瘤数目,MRI报告的肿瘤大小和BCLC分期显著不同。
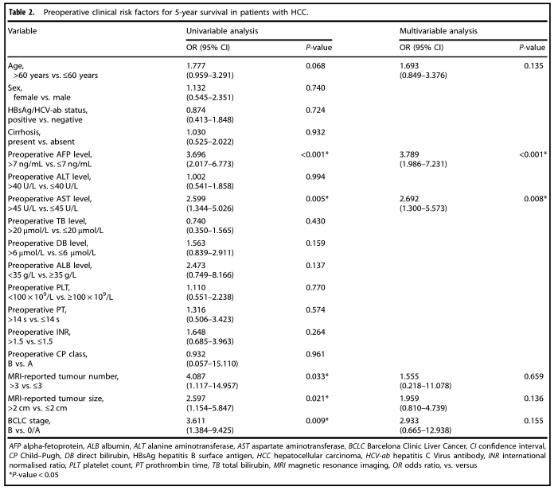
作者进行了单变量和多变量logistic回归分析,以确定与5年生存率相关的术前临床危险因素并发现AFP和AST是独立的临床危险因素(表2)。
2. 特征选择和放射性signture构建:
作者首先删除了一些无效特征,在其余的3064个放射学特征中,选择了30个与生存最相关的特征。总共选择了150种放射性特征进行五重交叉验证,其中包括来自DCEI的44个,来自DWI的42个,来自T1WI的29个和来自T2WI的35个。接下来作者根据选择的放射性特征构建了放射性signature。在训练组(图3a)中,放射性组signature产生的平均AUC为0.9733,而在验证组中,其平均AUC为0.7025(图3b)。
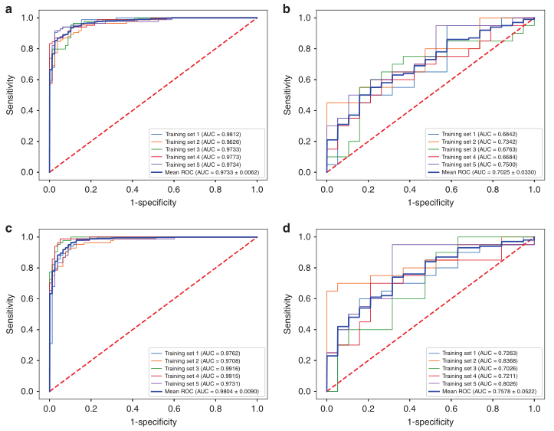 图3. 放射性标记和放射性模型的ROC曲线
图3. 放射性标记和放射性模型的ROC曲线
3. 放射医学模型的发展与性能:
在这一部分,作者将术前AFP和AST纳入放射模型。作者结合了放射性特征和术前AFP和AST的个体化放射性模型显示出更好的区分性,训练组的平均AUC为0.9804(图3c),而验证组的平均AUC为0.7578(图3d)。校准曲线表明,在训练集(图4a)和验证集(图4b)中,预测和实际5年生存率之间有很好的一致性。
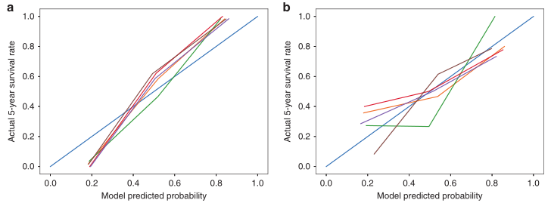

该研究构建了一个方便可行的放射学模型,该模型结合了MRI放射学signature和术前临床危险因素,可预测可切除HCC患者的5年生存率。

- 发表于 2020-04-07 16:53
- 阅读 ( 4284 )
- 分类:文献解读
你可能感兴趣的文章
- 文献解析(6)What?放射可以用于头颈鳞癌患者的治疗? 3981 浏览
