文献解析(6)What?放射可以用于头颈鳞癌患者的治疗?
看教程不够直观,那就看视频吧! >>点击加载视频


头颈部鳞状细胞癌(HNSCC)是一种常见的异质性恶性肿瘤,每年全球约有50万新发病例,包括口腔、口咽、鼻咽癌、下咽癌和喉癌。HNSCC的常规治疗包括手术、放疗和化疗,根据TNM分期和原发部位分别或联合使用。临床治疗的反应在HNSCC患者中差异很大,治疗结果不是十分理想,特别是在晚期疾病中。此外,化疗和放疗往往会产生显著的毒性。因此,为每个患者选择最佳的治疗策略,识别生物标志物是至关重要的。在头颈癌中,常规使用的是计算机断层扫描(CT)、磁共振(MR)和正电子成像术(PET)。从这些不同的影像学模式中提取的放射学特征已被证明在治疗HNSCC患者中是有用的。
因此,这次小编推荐的这篇文章研究的目的是基于放射学的非侵入性生物标记物来促进治疗相关分子亚型的转译,用于头颈鳞癌患者的治疗选择。
标题:Development and validation of radiomic signatures of head and neck squamous cell carcinoma molecular features and subtypes
杂志:EBioMedicine IF:6.68 发表时间:2019.06.27

1) 数据:研究分析了两个HNSCC数据集(TCGA-HNSCC用于模型开发,Stanford-HNSCC用于验证);基因组、统计学、临床数据来自 Genomic Data Commons (GDC)(https://portal.gdc.cancer.gov/), 而对应的CT数据来自The Cancer Imaging Archive (TCIA) (https://wiki.cancerimagingarchive.net/)。
2) 亚型分析:
文章分析了以下表型:HPV状态;基因表达亚型;通过MethylMix方法获得的DNA甲基化亚型;体细胞频繁突变集合。
3) 肿瘤体积分割:在进行特征提取之前,每个样本需要一位头颈放射科医师(M.C.经验大于10年)使用DICOM viewer Horos (https://horosproject.org)和每个轴向切片上的铅笔工具,手工勾画感兴趣的区域(ROIs,定义为总的肿瘤体积)。
4) 定量图像特征提取:首先将三维肿瘤切片重采样到1×1×1 mm3的等距体素。从总肿瘤体积感兴趣区域(ROI)中提取540个定量图像特征。这些定量的图像特征分为五组:(1)一阶特征,(2)形状和大小特征,(3)全局直方图特征,(4)纹理特征和(5)基于过滤的特征。
5) 模型的构建,选择与验证:整体流程如下图所示
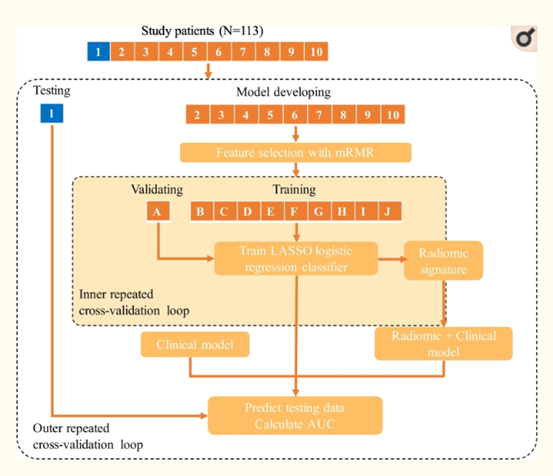
6) HPV预测模型的外部验证:训练一个模型来预测人乳头状瘤病毒状态,使用10 × 10-CV TCGA-HNSCC和Stanford-HNSCC的分层进行外部测试。

1. 患者特征和定量图像特征
基于研究的纳入和排除准则,这项工作研究了来自TCGA-HNSCC 的113个样本以及来自Stanford-HNSCC的53例样本(表1)。可以看出除原发肿瘤解剖部位、吸烟情况、临床T期和N期外,两组患者的临床特征无显著差异。然后,从分割出的大体肿瘤区域中提取540个定量图像特征。通过特征鲁棒性分析,540个特征中有491个符合鲁棒性标准,并保留下来进行进一步分析,并使用二项检验以及交叉验证来进一步选取特征。
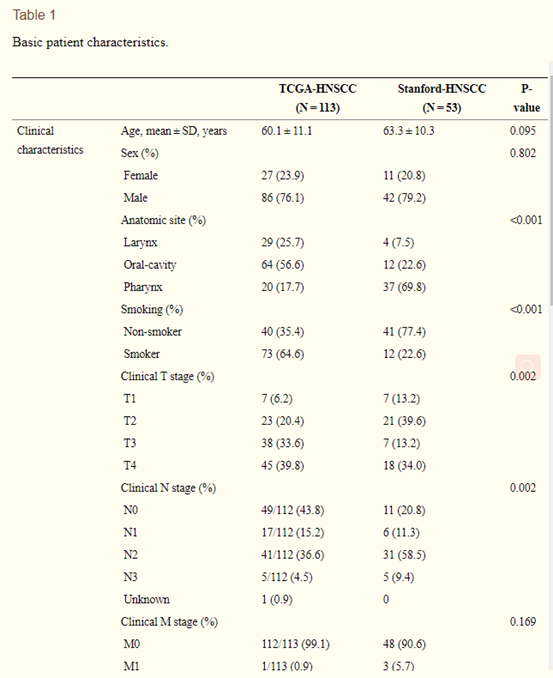
表1
2. HPV的放射学特征
作者首先检测定量图像特征是否可以区分RNA定义的HPV+和HPV-患者,可以看出这个放射学模型展示出了区分HPV+和HPV-状态的显著能力(图2a)。接下来,作者研究了在上述两种放射学模型中,哪些特征组是最重要的,为了进一步解释HPV的放射学模型,作者展示了两个在口咽肿瘤患者的例子:根据RNA定义的HPV状态和DNA甲基化亚型HPV+状态,一个HPV+病例被正确预测,另一个HPV-病例也被正确预测(图2)。HPV+肿瘤是位于舌底右侧的实性强化病灶(图2b)。HPV-肿瘤在放射学上表现为较强的侵袭性,有椎前筋膜浸润的征象,咽部后脂肪模糊位于下口咽后壁,并延伸至下咽后壁(图2c)。
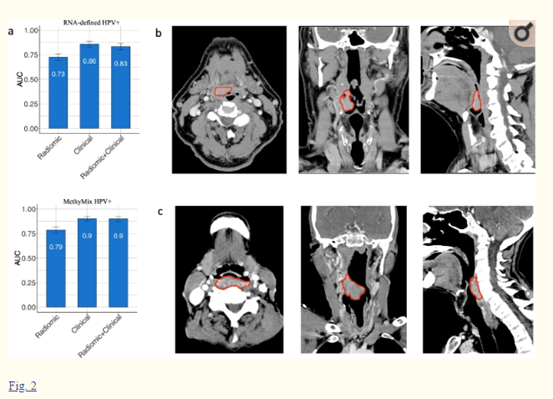
图2
3.预测其他DNA甲基化亚型、基因表达亚型以及体细胞突变
与甲基化HPV+相似,作者评估了其他四种DNA甲基化亚型的预测建模。这些分类器都取得了良好的性能(图3a)。接下来作者研究了以前定义的基因表达亚型的预测:非典型、经典、间质和基底(图3b)。此外,作者研究了放射学模型是否能够预测HNSCC中最常见的突变基因:NOTCH1、TP53、CDKN2A、PIK3CA和NSD1的体细胞突变。发现NSD1的性能最显著(图3c)。
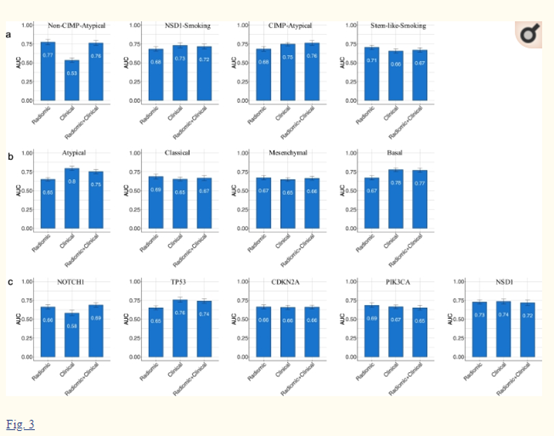 图3
图3
4. HPV放射学特征的外部验证
接下来,作者获得了一个独立的队列(Stanford-HNSCC)来进行验证。因此,首先在TCGA-HNSCC队列上建立训练模型,然后在Stanford-HNSCC队列上进行验证。所建立的模型如下:

作者还使用VIF分析测试了放射学特征和临床特征之间是否存在相互作用。然而,所有的VIFs都低于临床特征和/或放射体特征,这些特征结合起来训练临床模型或放射体+临床模型,表明这些特征之间缺乏多重共线性。放射性模型的验证结果表明效果良好,且当将放射学特征与临床特征相结合时,与放射学模型相比,性能显著提高(图4,5a)。与先前的研究一致,作者发现在HNSCC中,原发部位是HPV感染的一个强有力的指标。为了研究放射学模型是否对原发部位信息不可知,作者进一步以咽为原发肿瘤部位的Stanford-HNSCC患者为亚群对模型进行了测试,测试结果表明模型仍然效能良好(图5b)。
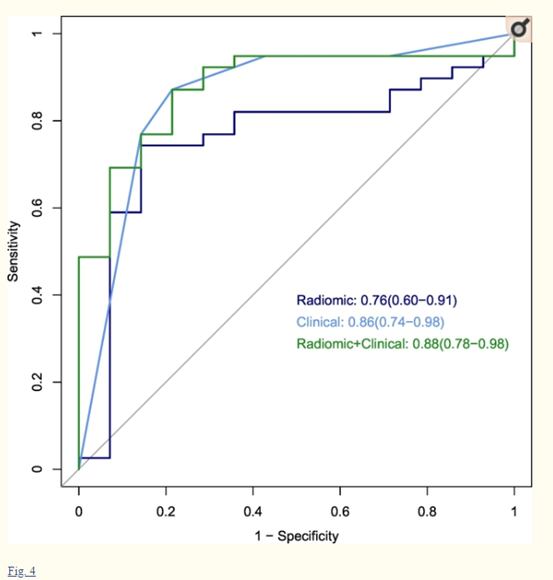 图4
图4
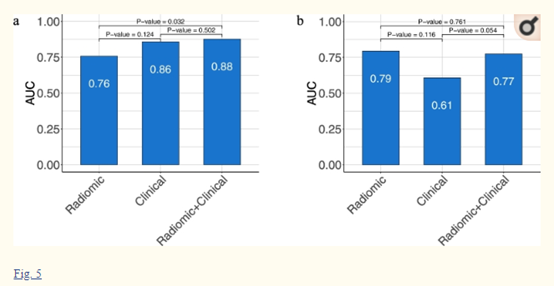 图5
图5
 结果表明,定量图像特征能够区分多种分子表型。作者识别了RNA-defined
HPV+ (AUC = 0.73)、DNA methylation subtypes MethylMix
HPV+(AUC = 0.79)、non-CIMP-atypical (AUC = 0.77)和Stem-like-Smoking (AUC = 0.71)以及NSD1突变(AUC = 0.73)的显著预测性能。作者在 Stanford中对HPV预测模型(AUC = 0.76)进行了外部验证。与临床模型相比,放射组模型优于NOTCH1突变、DNA甲基化亚型非典型性。研究也表明,放射组学可以作为一种非侵入性的工具来识别与治疗相关的HNSCC亚型,为患者分层、治疗分配和临床试验的纳入提供了可能性。
结果表明,定量图像特征能够区分多种分子表型。作者识别了RNA-defined
HPV+ (AUC = 0.73)、DNA methylation subtypes MethylMix
HPV+(AUC = 0.79)、non-CIMP-atypical (AUC = 0.77)和Stem-like-Smoking (AUC = 0.71)以及NSD1突变(AUC = 0.73)的显著预测性能。作者在 Stanford中对HPV预测模型(AUC = 0.76)进行了外部验证。与临床模型相比,放射组模型优于NOTCH1突变、DNA甲基化亚型非典型性。研究也表明,放射组学可以作为一种非侵入性的工具来识别与治疗相关的HNSCC亚型,为患者分层、治疗分配和临床试验的纳入提供了可能性。

1. Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7–30.
2. Belcher R., Hayes K., Fedewa S. Current treatment of head and neck squamous cell cancer. J Surg Oncol. 2014;110:551–574. doi: 10.1002/jso.23724. 2014/07/24.
3. Marur S., Forastiere A.A. Head and neck squamous cell carcinoma: update on epidemiology, diagnosis, and treatment. Mayo Clin Proc. 2016;91:386–396. doi: 10.1016/j.mayocp.2015.12.017. 2016/03/06.
4. Ang K.K., Harris J., Wheeler R. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med. 2010;363:24–35.
5. Gillison M.L., Koch W.M., Capone R.B. Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J Natl Cancer Inst. 2000;92:709–720.
6. Chaturvedi A.K., Engels E.A., Pfeiffer R.M. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol. 2011;29:4294–4301. doi: 10.1200/JCO.2011.36.4596. 2011/10/05.

文献解析(1)如何构建关系网络来更好的揭示一些相关的生物学机制?
文献解析(2)影响EGC病人使用ICI反应的关键因子是什么?
文献解析(3)是什么基因分类器竟能应用到头颈癌病人预后以及靶向治疗的药物反应评估中?
文献解析(4)这篇研究确定了一个高效的DNA损伤修复相关风险信号作为预测低度胶质瘤预后的指标!
文献解析(5)表观遗传时钟与共识分子亚型和结直肠癌总体生存率的关系
- 发表于 2019-11-26 14:40
- 阅读 ( 3855 )
- 分类:文献解读
