文献解读(5)具有丰富瘤内CD103+CD8 + T细胞的胃癌免疫原性亚型的鉴定和验证
看教程不够直观,那就看视频吧! >>点击加载视频

在一些恶性肿瘤中,肿瘤内CD103+CD8+T细胞与延长生存时间有关。然而,CD103+CD8+T细胞在胃癌中的临床意义尚不清楚。那么今天给大家介绍的这篇文章就是关于这个的,其发表在British Journal of Cancer上,影响因子5.416。


1)研究人群
在该研究中,起初是从中山医院获得了从2007年至2008年间接受胃癌根治术的496名胃癌患者的数据。在这其中只有468例具有关于化疗,临床病理数据和生存结果的全面信息,可以进行全面分析。在这其中作者排除了9例远处转移的患者以及免疫组化后组织芯片(TMAs)上的11个点消失。所以最后作者将448名患者纳入研究并且回顾性收集了临床数据。作者根据美国癌症联合委员会(AJCC)TNM分类的第7版确定了癌症分期。根据NCCN胃癌和患者意愿指南,对患者进行了术后辅助化疗(ACT)。作者还使用了两个独立的公共数据集GSE84437和GSE62254进行外部验证。在排除远处转移或数据不完整的患者后,随后的分析中包括431名来自GSE84437的患者和220名来自GSE62254的患者。此外,中山医院普外科在手术过程中总共获得了36个新鲜肿瘤组织样本,用于流式细胞仪分析。
2)多色免疫组化和免疫荧光分析
作者进行了免疫组化的构建,并进行了双重免疫组织化学(IHC)染色。这里面详细的操作步骤就不细说了。
3)IHC标本中CD103+CD8 +T细胞密度的评估双重IHC染色后,CD103和CD8分别染成棕色和蓝色。CD103+CD8+T细胞为深棕色,很容易与单阳性细胞区分开(图1d)。在显微镜下,所有标本中的每个肿瘤区域均以×200放大倍率捕获了三个最具代表性的高倍视野。然后,两位病理学家对患者的临床资料视而不见,确定了每个区域的CD103+CD8+细胞(深棕色染色细胞)、CD103-CD8+细胞(蓝色染色细胞)和CD103+CD8-细胞(浅棕色染色细胞)的数量。另外,作者将CD103+CD8 +和CD103-CD8+细胞的数目相加为总CD8+T细胞的数目,而CD103+细胞的数目为CD103+CD8+和CD103 + CD8-细胞的总和。
4)流式细胞仪
作者制备了新鲜分离的胃癌组织。简而言之,将红细胞溶解后,将样品与人BD Fc阻断物一起孵育,然后在黑暗中于4°C用指示的单克隆抗体(mAbs)染色30分钟。接下来洗涤染色的细胞,并重悬于细胞染色缓冲液中。然后使用FITC Annexin V细胞凋亡检测试剂盒I评估细胞凋亡。随后,将染色的细胞用FACSCelesta流式细胞仪(BD Biosciences)分离,并用FlowJo软件(Tree Star)进行分析。
5)体外治疗测定
如上所述从新鲜肿瘤组织获得肿瘤单细胞悬液。如前所述,在含有抗CD3抗体和抗CD28抗体的检测培养基中,在培氏菌素或同型对照的存在下培养消化物。温育24小时后,收集细胞,洗涤,并通过流式细胞仪分析。
6)公开数据集分析
从GEO中下载了GSE84437和GSE62254数据集,基于微阵列数据,通过CIBERSORT算法使用LM22作为表达特征,估计肿瘤内CD8+T细胞的丰度。由于CIBERSORT不包含CD103 +CD8+T细胞子集,因此作者使用了单样本基因集富集分析(ssGSEA)来估计肿瘤内CD103+CD8+T细胞的相对丰度。简而言之,作者首先从MSigDB获得了CD103+CD8+T细胞的标记基因集(GSE39152_CD103_NEG_VS_POS_MEMORY_CD8_TCELL_DN)。接下来,作者应用基因组变异分析(GSVA)R软件包及其ssGSEA方法,进一步获得两个GEO数据集中每个样本的标记基因组的GSVA分数。GSVA评分代表每个样本中CD103+CD8+ T细胞标记基因组的绝对富集程度,表明肿瘤内CD103 + CD8 + T细胞的相对丰度。
7)统计分析
这里面作者使用GraphPad Prism,R软件,MedCalc或IBM SPSS Statistics软件进行统计分析。对于所有三个独立队列中的所有标记,使用X-tile软件通过最小P方法确定用于区分高密度和低密度组的临界值。最终,37/HPF,-0.007593和0.268分别被确定为中山医院组、GSE84437和GSE62254中CD103+CD8+T细胞的临界值。使用Kaplan-Meier方法和对数秩检验进行生存分析。使用Spearman进行了相关性分析。

(1)胃癌CD103 + CD8 + T细胞的存在及其与临床病理特征的关系
人胃癌组织单细胞悬液的流式细胞仪分析表明,CD103主要在胃癌组织的CD3 + CD8 + T细胞上表达(图1a,b)。然后,作者通过免疫荧光法证实了福尔马林固定石蜡包埋的胃癌组织中肿瘤浸润淋巴细胞上CD103和CD8的共表达(图1c)。作者采用了双染色免疫组化法来评估胃癌组织微阵列中肿瘤内CD103+CD8+T细胞的密度(图1d)。之后,作者分析了三个独立队列中CD103 + CD8 + T细胞浸润与临床病理特征之间的关联,但未发现显著关联。
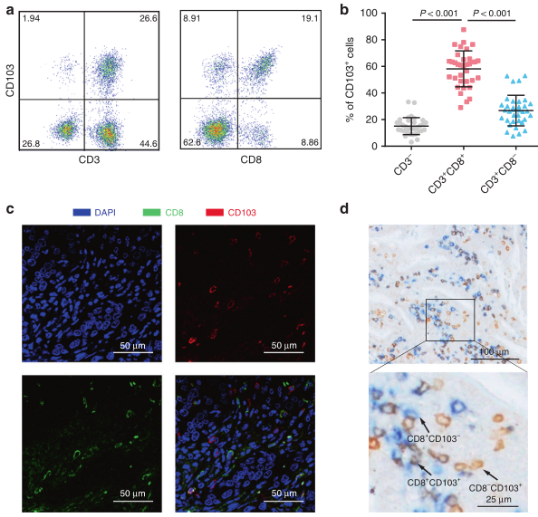
图1. 人胃癌组织中CD103 + CD8 + T细胞的鉴定
(2)CD103 + CD8 + T细胞在胃癌患者中具有出色的预后能力
为了评估CD103 + CD8 + T细胞在抗肿瘤免疫方面的临床意义,作者在三个独立的胃癌队列中进行了Kaplan–Meier分析。结果显示肿瘤内CD103+CD8+T细胞的更高密度与所有三个队列中总生存率(OS)的提高相关(图2a、b、c)。尽管CD8 + T细胞与患者的存活率相关,但很可能某些肿瘤内CD8 + T细胞只是免疫反应的旁观者,而不是活跃的参与者。因此,作者打算探讨肿瘤内CD8 + T细胞上的CD103表达是否可以鉴定出具有较高胃癌预后能力的CD8 + T细胞亚群。结果显示总的CD8 +T细胞密度越高,三个队列的总生存率越高(图2d,e,f)。有趣的是,当作者将CD8+T细胞与CD103 +CD8+ T细胞结合进行生存分析时,发现CD103+CD8+T细胞密度可以将高CD8+T细胞浸润的患者进一步分为两个具有明显生存差异的亚组(图2g,h, i)。这些结果表明CD103+CD8+T细胞较CD8+T细胞具有更好的预后能力。
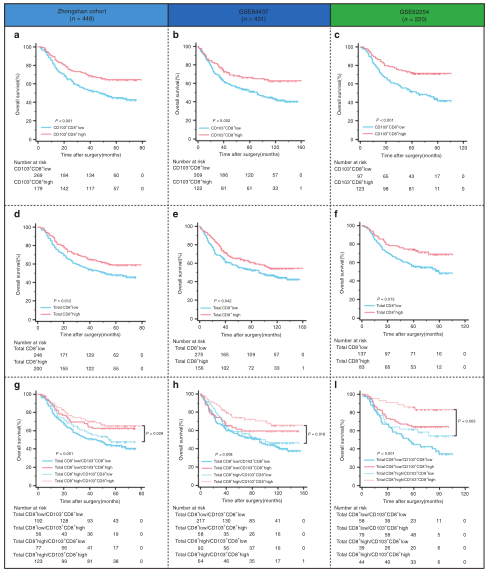
图2. 肿瘤内CD103 + CD8 + T细胞在胃癌患者中的预后价值
(3)CD103 + CD8 + T细胞浸润增加预示II / III期胃癌患者术后辅助化疗的疗效更好
在中山医院和GSE62254队列中,以氟尿嘧啶为基础的ACT治疗与TNM II/III期胃癌患者更好的OS相关(图3a,b)。为了评估肿瘤内CD103+CD8 + T细胞对ACT的预测价值,作者调查了中山队列TNM II / III期患者和CD103+CD8+T细胞浸润组的GSE62254患者中ACT与OS的相关性。结果显示对于高CD103+CD8+T细胞浸润的患者,ACT在两个队列中都能显著改善生存(图3c,d)。但是在两个队列中,ACT并没有改善低CD103+CD8+T细胞浸润患者的总体生存(图3e,f)。这些结果表明,肿瘤内CD103 + CD8 + T细胞浸润可以识别出可能从辅助化疗中获益更多的患者。
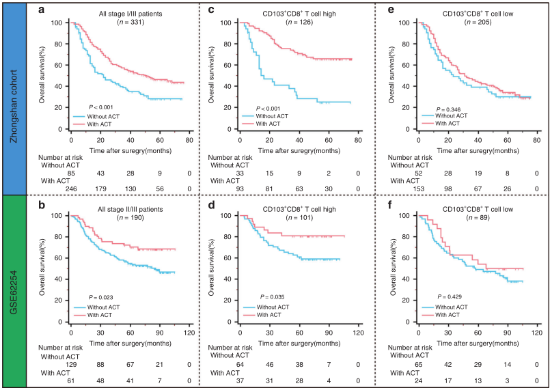
图3. 肿瘤内CD103 + CD8 + T细胞对胃癌患者辅助化疗的预测价值
(4)肿瘤内CD103 + CD8 + T细胞显示组织驻留特征
先前的研究表明CD103+CD8+T细胞是一个主要存在于非淋巴组织的亚群,因此作者探讨了它们在胃癌中是否保留这一特征。作者发现CD103 + CD8 + T细胞表达的淋巴细胞的组织保留分子水平高于其他分子(图4a)。由于组织保留和组织出口相关分子的独特表达,作者假设此组织驻留形式受转录因子的独特谱表调控。在接下来的研究中,与CD103-CD8 + T细胞相比,在CD103 + CD8 + T细胞中观察到更高比例的RUNX3 +和HOBIT high / BLIMP-1 low细胞(图4c,e)。但是,TCF1是编码CCR7和CD62L的基因的转录激活因子,其CD103 + CD8 + T细胞亚群的频率明显低于CD103 + CD8 + T细胞(图4d)。这些结果表明肿瘤内CD103 + CD8 + T细胞表现出组织驻留特征。
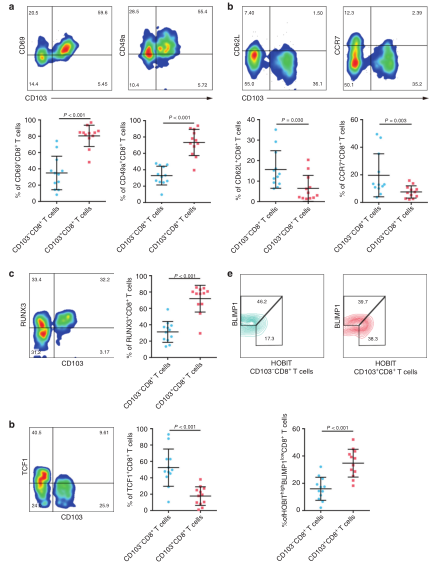
图4. 肿瘤内CD103 + CD8 + T细胞显示组织驻留特征
(5)胃癌中肿瘤内CD103 + CD8 + T细胞表现出高度活化的表型
在这一部分,作者研究了肿瘤内CD103 + CD8 + T细胞的独特功能表型。在CD103 + CD8 + T细胞中发现的Ki-67 +细胞的频率低于在CD103-CD8 + T细胞中的频率,这表明CD103 + CD8 +细胞具有较低的增殖能力。作者通过分析CD8 + T细胞产生细胞因子的能力来评估其效应功能,这些细胞因子包括白介素2(IL-2),干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)。结果显示CD103 + CD8 + T细胞仅显示较高的IFN-γ表达(图5c)。此外,作者还检测了三种细胞因子(IFN-γ,IL-2和TNF-α),发现IFN-γ+TNF-α+IL-2-和IFN-γ+TNF-α-IL-2-细胞的频率增加,但与相应的CD103-细胞相比,CD103+CD8+T细胞中IFN-γ-TNF-α-IL-2+细胞的频率降低(图5d)。值得注意的是,作者发现胃癌中CD103+CD8+T细胞表达的共抑制受体水平也高于CD103-CD8+T细胞(图5e)。总的来说,这些数据表明,肿瘤内CD103 + CD8 + T细胞表现出高度活化的表型,与CD103-CD8 + T细胞相比,具有较低的增殖潜能,较高的细胞毒性和较高的共抑制受体表达,以及独特的细胞因子生产能力。
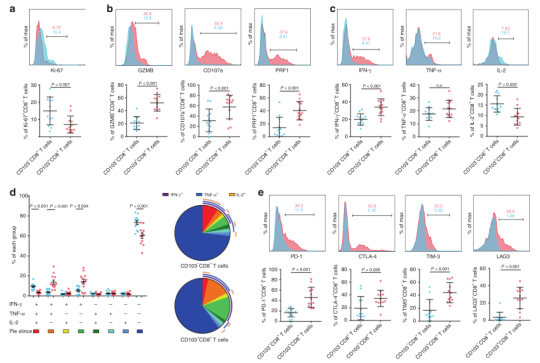
图5. 胃癌组织中肿瘤内CD103 + CD8 + T细胞的功能特征
(6)胃癌中PD-1阻断后,肿瘤内CD103 + CD8 + T细胞比CD103 − CD8 + T细胞功能更强
先前的研究表明,CD103+CD8+T细胞而不是CD103-CD8+T细胞是免疫检查点抑制剂的理想靶点。因此,作者进一步检查了CD103 + CD8 + T细胞和CD103-CD8 + T细胞对胃癌PD-1阻滞的反应是否不同。流式细胞仪分析表明,PD-1阻断对CD103 + CD8 + T细胞的效应分子表达比对CD103-CD8 + T细胞具有更深远的影响(图6a,b)。然而,作者发现,CD103-CD8 + T细胞较CD103 + CD8 + T细胞在PD-1阻断后显示出增殖爆发(图6c)。值得注意的是,随着单抗治疗后肿瘤内CD103+CD8+T细胞频率的增加,Annexin V+上皮细胞增多,Ki-67+上皮细胞减少(图6d)。这些数据表明,CD103 + CD8 + T细胞比CD103-CD8 + T细胞对PD-1阻断反应更敏感,并且有可能成为免疫治疗功效的预测因子。

图6. PD-1阻断后,肿瘤内CD103 + CD8 + T细胞功能恢复

CD103 + CD8 + T细胞可能是预测胃癌患者预后和治疗效果的有用标志物。致力于增加肿瘤内CD103 + CD8 + T细胞频率可能是胃癌的一种新的治疗策略。

文献解读(2)基于MRI的放射学模型可在术前预测肝细胞癌患者的5年生存率
- 发表于 2020-04-14 15:38
- 阅读 ( 10228 )
- 分类:文献解读
你可能感兴趣的文章
- 文献解析(2)影响EGC病人使用ICI反应的关键因子是什么? 3268 浏览
- 文献分享(4)联合抑制PD-L2和TGF-β2可能会提高免疫治疗的效果? 4091 浏览
- 文献分享(1)肿瘤细胞和正常细胞之间mRNA丰度的关联 6633 浏览
- 生信文章解析(第七篇)非小细胞肺癌中免疫应答相关的突变特征以及驱动基因 10122 浏览
- 文章分享(七)m1A甲基化酶基因竟与mTOR存在可靠的联系? 4874 浏览
