文献分享(4)联合抑制PD-L2和TGF-β2可能会提高免疫治疗的效果?
看教程不够直观,那就看视频吧! >>点击加载视频


程序性细胞死亡蛋白-1(programmed death-1,PD-1)及其配体(PD-L1)抑制剂是免疫哨点单抗药物,其应答之广度、深度、和持久性均十分罕见,是近年来肿瘤免疫疗法研究的热点。事实上,除了PD-L1之外,PD-1还有另外一个配体PD-L2,PD-1主要表达在免疫细胞上,PD-L1表达在免疫细胞细胞和肿瘤细胞上,而PD-L2主要表达在免疫细胞上。
PDAC预后差,5年生存率仅8%[1]。虽然手术切除仍是唯一的治疗方法,但大多数患者仍需接受全身的化疗去预防该病的再次复发。与传统的化疗方式相比,肿瘤免疫治疗已经取得显著进展[2,3]。为了克服PD-1和PD-L1免疫治疗在治疗疾病过程中的瓶颈,进一步提高免疫标志物预测切除PDAC患者生存的准确性,我们分析了肿瘤内和基质成分的多种免疫指标一起结合使用,看该整合的标志物模型是否可以预测PDAC术后生存。
今天小编要和大家分享的一篇作者在本研究中,zhang等人将305个切除PDAC的石蜡样本作为训练集,并对这些样本进行免疫组化实验去检测PD-L2、CD3、CD8、TGF-β2和FOXP3的表达。
zhang等人的研究结果指出了PD-L2在PDAC中确实有着其预后价值,使用这个基于免疫标记模型比单个免疫标志物的预后预测能力更好,PD-L2和TGF-β2表达正相关,如果从抑制剂的角度,使用的是抑制这两个蛋白的表达的药物,某种程度上来说,这会使得免疫治疗取得更好的效果。同时,虽然PD-L2在免疫治疗的探索尚未像对PD-L1那样得到充分的研究,但PD-L2仍然与免疫调节和肿瘤进展密切相关,并为未来的治疗提供了新的方向。
标题:A PD-L2-based immune marker signature helps to predict survival in resected pancreatic ductal adenocarcinoma
杂志:Journal for ImmunoTherapy of Cancer IF:8.676 发表时间:2019.8.29

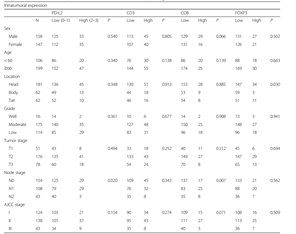
(1)数据:455例在复旦大学上海肿瘤中心接受手术切除的原发性PDAC患者。将2011年1月到2015年7月的接受切除的原发性PDAC病人作为训练集(n = 305),2015年8月到2016年5月接受切除的原发性PDAC病人作为验证集(n = 150)。这305个PDAC病人的具体信息如Table 1所示。
Table
1. 肿瘤内PD-L2的表达及PDAC样本的临床病理特征
(2)免疫组化实验:通过免疫组化实验去检测PD-L2、CD3、CD8、TGF-β2和FOXP3的表达,并且结果由两位这方面的专家统一确定。
(3)GSEA分析:基于PD-L2的表达高低,将TCGA数据库中的PDAC病人分成两组,参数设置为:1000 permutations & Affymetrix chip platform(其他选择默认参数)。
(4)随机森林模型:通过“randomForestSRC”包,以最小深度和变量重要性挑选变量去构建随机森林模型。
(5)免疫标志物风险得分模型:(0.637 * intratumoral PD-L2) - 0.437 * intratumoral CD3 + (0.499 * stromal FOXP3),该模型的曲线下面积(AUC)由“survivalROC”计算得到。
(6)临床参数标志物风险得分模型: (0.911 * AJCC stage) + (0.510 * grade differentiation) + (0.633 * T stage) + (1.087* N stage)[4,5]
 (1)PD-L2、CD3、CD8和FOXP3在训练集中的表达情况:结合Fig 1,发现膜上的或细胞质内的PD-L2在218例患者有表达(如Fig 1a),基质的PD-L2在67例患者中有表达(如Fig 1b)。Fig 1c显示CD3、CD8和FOXP3的表达情况。Fig 1d表明PD-L2、CD3、CD8和FOXP3的细胞密度与肿瘤和基质细胞的状态强相关(p < 0.001)。进一步,通过线性相关分析发现CD3、CD8和FOXP3的表达与PD-L2的表达正相关(如Fig 1e)。通过U检验发现CD3、CD8和FOXP3的表达在PD-L2表达低和PD-L2表达低两组样本中无差异(如Fig 1f)。
(1)PD-L2、CD3、CD8和FOXP3在训练集中的表达情况:结合Fig 1,发现膜上的或细胞质内的PD-L2在218例患者有表达(如Fig 1a),基质的PD-L2在67例患者中有表达(如Fig 1b)。Fig 1c显示CD3、CD8和FOXP3的表达情况。Fig 1d表明PD-L2、CD3、CD8和FOXP3的细胞密度与肿瘤和基质细胞的状态强相关(p < 0.001)。进一步,通过线性相关分析发现CD3、CD8和FOXP3的表达与PD-L2的表达正相关(如Fig 1e)。通过U检验发现CD3、CD8和FOXP3的表达在PD-L2表达低和PD-L2表达低两组样本中无差异(如Fig 1f)。
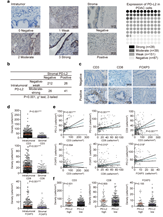 Fig
1. PD-L2、CD3、CD8和FOXP3的表达
Fig
1. PD-L2、CD3、CD8和FOXP3的表达
(2)PD-L2、CD3、CD8和FOXP3与PDAC临床病理学特征的关系:其中,这305个病人的临床病理学特征在Table 1中进行展示,进一步通过单因素和多因素cox回归分析,刻画PD-L2、CD3、CD8和FOXP3的表达对PDAC病人的预后的影响,发现肿瘤内的PD-L2、CD3和FOXP3以及基质内的CD3均可以作为独立的临床因素(如Table 2所示)。 Table 2. 单因素和多因素回归分析(OS)

(3)预后模型预测PDAC病人的预后:根据PD-L2、CD3、CD8和FOXP3的表达,将样本分成相应的高低表达组,通过log-rank检验分析相应的高低样本组的生存是否差异,发现PD-L2高表达与差的预后相关(如Fig 2a)。通过“randomForestSRC”包,基于最小深度在肿瘤内和基质中去构建随机森林模型,发现肿瘤内的CD8的深度最大(2.1470),因此将其剔除。在变量重要性分析中,PD-L2是最对模型影响最大的变量(VIMP=0.0262),而肿瘤内CD8和FOXP3、基质的CD3和CD8的VIMP分别是-0.0069、-0.0031、-0.0068和-0.0069(如Fig 2b),所以,最后只用肿瘤内PD-L2、CD3以及基质内的FOXP3不同表达的高低去构建最终的随机森林模型(如Fig 2d),并在训练集和测试集中去分析各组预后(如Fig 2c)。进一步,结合PD-L2、CD3以及基质内的FOXP3构建风险模型,并用瀑布图进行展示(如Fig 2e)。
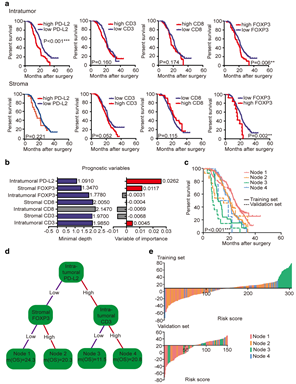 Fig
2. 预后分析结果图
Fig
2. 预后分析结果图
(4)系统探索与PD-L2表达相关的基因:依照方法中的免疫标志物风险得分模型和临床参数标志物风险得分模型,分别在训练集和测试集中去验证两个模型5年生存率的AUC(如Fig 3a)。为了进一步理解PD-L2与其他构成肿瘤微环境分子的作用,使用TCGA数据库中的数据,基于PD-L2的表达将样本分成PD-L2低表达和PD-L2高表达的样本组,GSEA中的C2集合作为背景参照,具体参数如方法中所示,最终得到PD-L2高表达样本富集到的功能(如Fig 3b)。接下来,进一步去统计在Fig 3b中所富集的通路中的基因出现的次数,也即想评价基因的贡献率(如Fig 3c),TGF-β2的出现次数最多,因此表明TGF-β2在PD-L2高表达的样本扮演着重要的角色,在Fig 3c出现次数最多的5个基因中,有4个基因的jaccard系数大于0.02。在305个PDAC训练集样本中,对TGF-β2做免疫组化实验,发现TGF-β2在91.1%的PDAC病人中有表达,其中,64.4%弱表达、27.7%中度表达以及7.9%强表达(如Fig 3e)。进一步分析,发现TGF-β2的高低表达样本生存差异,高TGF-β2表达和病人差的预后相关(如Fig 3f)。通过cystoscape软件绘制PD-L2关系网络图,发现TNFRSF14、CD86、CD38、BLTA、CTLA-4、CD160和CD160与PD-L2相关(如Fig 3f)。
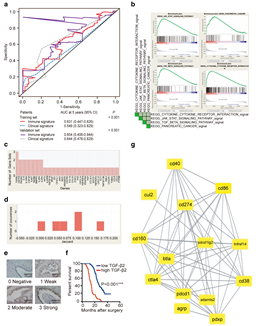 Fig
3. PD-L2的网络分析
Fig
3. PD-L2的网络分析
 总的来说,zhang等人识别了由PD-L2、肿瘤内CD3以及基质FOXP3组成的免疫预后风险模型,该模型所得到的风险得分的高低显著和PDAC病人的OS显著相关,并且该免疫预后模型比由临床参数构成的风险模型预测性能还要好。PD-L2和TGF-β2两者正相关,且两者的高表达都和病人差的预后相关,从系统调控的角度,联合抑制这两个蛋白的表达可能会提高免疫治疗的效果。
总的来说,zhang等人识别了由PD-L2、肿瘤内CD3以及基质FOXP3组成的免疫预后风险模型,该模型所得到的风险得分的高低显著和PDAC病人的OS显著相关,并且该免疫预后模型比由临床参数构成的风险模型预测性能还要好。PD-L2和TGF-β2两者正相关,且两者的高表达都和病人差的预后相关,从系统调控的角度,联合抑制这两个蛋白的表达可能会提高免疫治疗的效果。

1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018; 68(1):7–30.
2. Luke JJ, Flaherty KT, Ribas A, Long GV. Targeted agents and immunotherapies: optimizing outcomes in melanoma. Nat Rev Clin Oncol. 2017;14(8):463–82.
3. Meng X, Liu Y, Zhang J, Teng F, Xing L, Yu J. PD-1/PD-L1 checkpoint blockades in non-small cell lung cancer: new development and challenges. Cancer Lett. 2017;405:29–37.
4. Yang HI, Yuen MF, Chan HL, Han KH, Chen PJ, Kim DY, et al. Risk estimation for hepatocellular carcinoma in chronic hepatitis B (REACH-B): development and validation of a predictive score. Lancet Oncol. 2011;12(6):568–74.
5. Zhou M, Zhao H, Wang Z, Cheng L, Yang L, Shi H, et al. Identification and validation of potential prognostic lncRNA biomarkers for predicting survival in patients with multiple myeloma. J Exp Clin Cancer Res. 2015;34:102.

文献分享(3)sEV相关基因表达特征(3-PPI-Mod)与肿瘤内缺氧状态显著相关???
文献分享(6)对表观遗传酶进行综合泛癌分析揭示了癌症中表观基因组失调的普遍模式
文献分享(7)circRNA特征预测II / III期结肠癌术后复发
- 发表于 2019-11-25 19:12
- 阅读 ( 4098 )
- 分类:文献解读
你可能感兴趣的文章
- 文献解读(5)具有丰富瘤内CD103+CD8 + T细胞的胃癌免疫原性亚型的鉴定和验证 10240 浏览
- 文献解读(3)TIGS是一种有效的肿瘤内在生物标志物,可用于ICI应答预测 6421 浏览
- 文献解析(9)MB干性特征分析 6643 浏览
- 文献分享(1)肿瘤细胞和正常细胞之间mRNA丰度的关联 6701 浏览
- 生信文章解析(第一篇)在乳腺癌中,MAPK通路的突变驱动扰动与肿瘤内免疫反应负相关? 7585 浏览
