MALAT-1简介
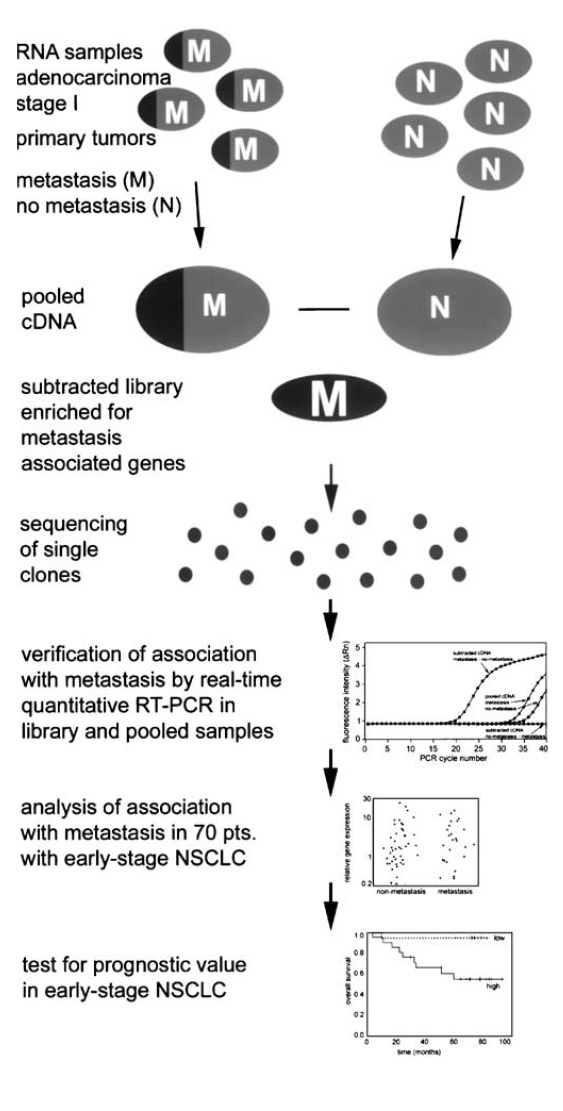
MALAT-1的发现2003年,Ji等从初期非小细胞肺癌患者的肿瘤细胞中筛选出数个差异表达基因,其中包括含一个与肺癌转移和预后相关的未知转录物,采用RACE法扩增到一个长约940nt的片段,经检索比对...
看教程不够直观,那就看视频吧! >>点击加载视频
MALAT-1的发现
2003年,Ji等从初期非小细胞肺癌患者的肿瘤细胞中筛选出数个差异表达基因,其中包括含一个与肺癌转移和预后相关的未知转录物,采用RACE法扩增到一个长约940nt的片段,经检索比对,该片段定位于人染色体11q13,属于长约8.7kb的a基因。Ji等根据其与NSCLC发生发展的关系,将a基因转录物重命名为肺癌转移相关转录本1(MALAT-1),后来也被称作NEAT2。MALAT-1缺乏有意义的开放性编码框,在体外无法翻译蛋白质,属长链非编码RNA(lncRNA)。MALAT-1是第一个与肺癌疾病相关联的长链非编码RNA。10多年前发现关于MALAT-1的大量数据积累,包括MALAT-1与其他癌症细胞或疾病的关联、对其生物合成的见解、与其他细胞的相互作用及分子机制等。
通过差减杂交在非小细胞肺癌中筛选到一个高表达的转录本MALAT-1.
lncRNA的来源
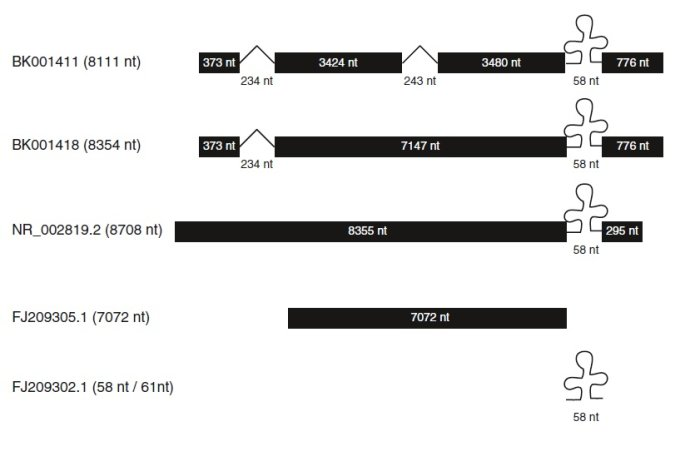
MALAT1 编码基因定位于染色体11q13.1,转录本序列长约 8 kb,属于基因间转录本。MALAT1由多个启动子控制转录,至于哪个启动子占主导,哪些因素调控启动子转录有待进一步研究,研究人员数据表明A549细胞启动的转录本位优势转录本。在人的SK-N-SH神经母细胞瘤细胞株,垂体后叶催产素能够增强MALAT-1表达,而且cAMP反应原件结合蛋白与MALAT-1启动子结合是MALAT-1在神经母细胞瘤重要调控因子。
《MALAT1 -- a paradigm for long noncoding RNA function in cancer.》J Mol Med (Berl). 2013 Jul;91(7):791-801.
MALAT-1的结构剪切
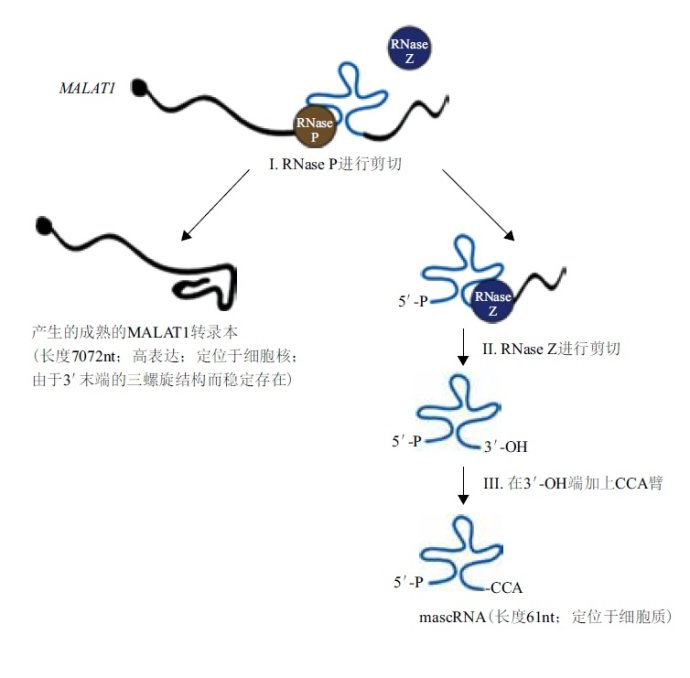
在转录后水平,两个内源RNA酶-RNaseP和RNaseZ可以修饰MALAT-1。初生的转录产物MALAT-1在其多聚腺苷酸位点上游几百碱基处可形成tRNA样三叶草二级结构,此结构能被RNaseP特异识别,RNaseP结合三叶草结构后迅速在其最近上游端进行剪切,形成大小为7072nt的MALAT-1成熟转录本和近3'端小转录本两个片段。小转录本被转运至胞浆,经RNaseZ剪切加工,并在CCA添加酶的作用下,其3'端加上CCA臂后形成大小约为61nt的胞浆成熟tRNA样转录本,称为MALAT-1-associated small cytoplasmicRNA(mascRNA),随后被运送到细胞质。
晶体结构解析MALAT-1的3' 末端形成三螺旋结构
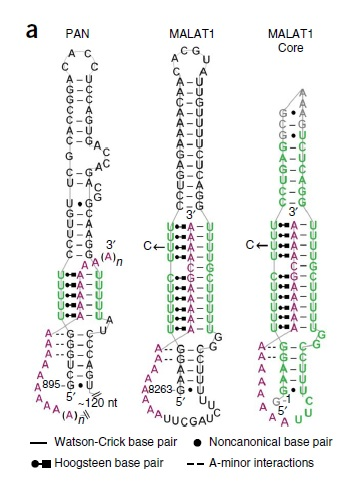
《Structural insights into the stabilization of MALAT1 noncoding RNA by a bipartite triple helix》Nature Structural & Molecular Biology, 2014, 21(7):633-40
MALAT1的5'端没有帽子结构,不参与蛋白质的翻译,3'端没有ploy(A)尾,但其是一个非常稳定的lncRNA,最新研究发现,可能是由于在3'末端形成了三螺旋结构。Wilusz等研究发现MALAT13'末端形成的三螺旋结构可保护MALAT13'端免受3'-5'核酸外切酶的剪切,从而维持MALAT1的完整性。
MALAT-1在大肠癌细胞中致癌过程的增强作用结构域定位于?1500nt的片段,在MALAT-13'端附近(nts6918-8441)。此区域包含了MALAT-1的高度保守的3'-末端序列(nts8254-8413),具有plolyA尾,这个尾侧翼具有两个结构元件:类似于一个核固位元件(nuclear-retention-element,ENE)和下游的类似tRNA的结构,这个结构命名为MALAT1相关的小胞质RNA(mascRNA).mascRNA由RNA酶P(RNase-P)加工产生MALAT-1的3'末端,这个3’末端具有plolyA尾,形成一个三股螺旋的ENE结构,与ENE类似结构在病毒RNA和基因组RNA中已经被发现。
聚腺苷酸化核(polyadenylatednuclear,PAN)RNA3'端附近的ENE,是一个被表征化的lncRNA,它由卡波西氏肉瘤相关疱疹病毒(KSHV)在感染的裂解阶段产生的。它可以保护3'PAN-RNA免于快速脱腺苷依赖的细胞核衰变,它形成三螺旋,在U富含的内部环(loop)中扣住了PAN的3'端的poly(A)尾,并命名为ENE+A。PAN ENE+A强活性重要结构部分包括:
1.五个连续的U•A-U三体组成的三螺旋;
2.三螺旋侧翼的双螺旋中是经典的Watson-Crick碱基配对;
3.邻近三螺旋有连续的GC碱基配对的A-minor反应。
MALAT-1的核定位
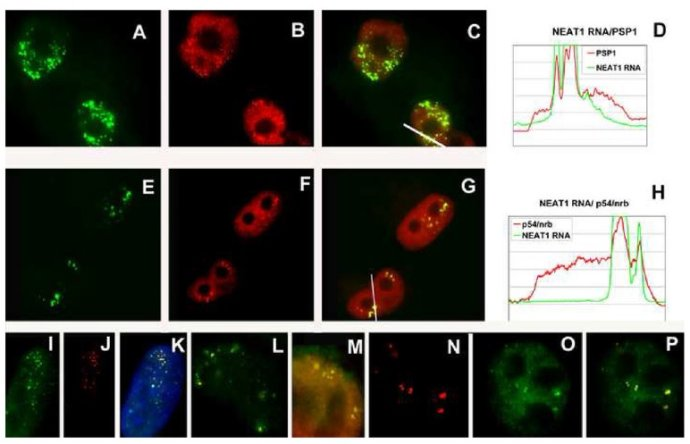
LncRNA的功能在很大程度上决定于亚细胞结构定位的特性。与MALAT1同一家族的成员,核富集常染色体转录物1(Nuclera-enriched autosomal transcript,NEAT1)参与核内的超核小斑结构的组装和结构维持。与NEAT1相似,MALAT1基因特异性定位于细胞核核小体核斑(Nuclearspeckles)区,在该区进行转录,但其在该核斑区富集是以RNA聚合酶Ⅱ依赖的转录被激活为前提。进一步研究发现,干扰MALAT1不影响某些核斑的表达、定位,因此MALAT1可能不是组成核斑的结构成分。同时,MALAT1序列本身还存在两个必需的独立结构域指导其定位于核斑,分别位于MALAT1序列的1961-3040nt和6387-7011nt,这两个区域中的任何一个基因突变都导致MALAT1定位失常,游离到细胞质中,失去功能。例如,用siRNA干扰MALAT-1后,MALAT1分散到核质中,失去调节基因表达的功能。
《Unique features of long non-coding RNA biogenesis and function》Nat Rev Genet. 2016 Jan;17(1):47-62.
MALAT-1的高度保守性
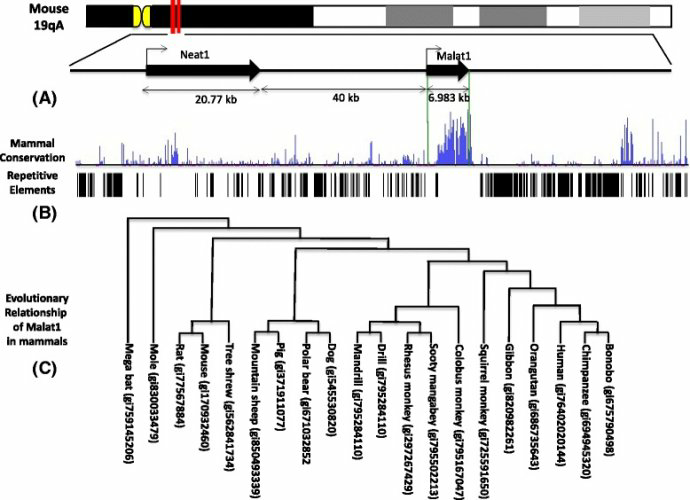
《Malat1 as an evolutionarily conserved lncRNA, plays a positive role in regulating proliferation and maintaining undifferentiated status of early-stage hematopoietic cells》BMC Genomics201516:676
MALAT-1在哺乳动物进化中高度保守,核苷酸序列3'末端5kb左右人鼠同源性高达90%,这都提示其在进化过程中MALAT1扮演了重要角色。MALAT-1的全序列存在4个人鼠高度同源区域,提示这些区域极可能为MALAT1的功能性区域。
lncRNA跨物种高度表达
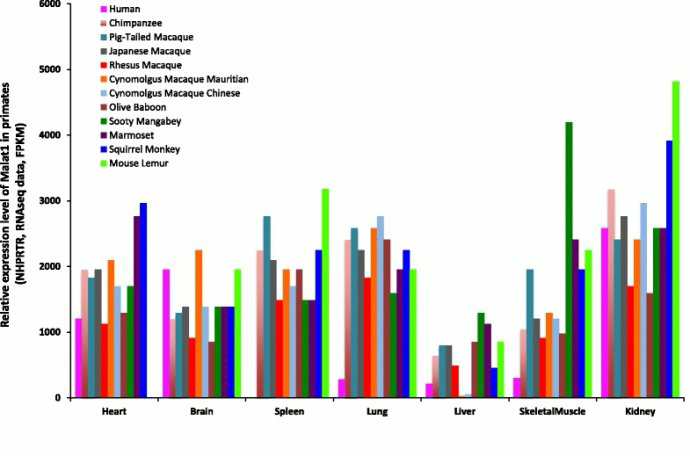
《Malat1 as an evolutionarily conserved lncRNA, plays a positive role in regulating proliferation and maintaining undifferentiated status of early-stage hematopoietic cells》BMC Genomics201516:676
Malat-1在包括人类在内的灵长类动物中的很多组织中广泛表达。
MALAT-1调节剪接
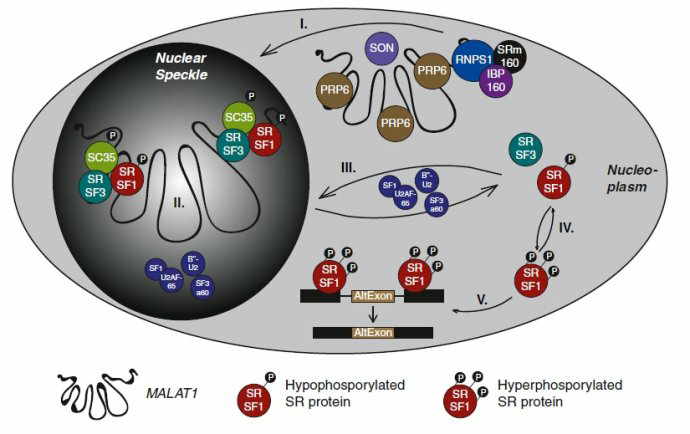
《MALAT1 -- a paradigm for long noncoding RNA function in cancer.》J Mol Med (Berl). 2013 Jul;91(7):791-801.
已知mRNA前体加工过程中,核内核小斑的丝氨酸/精氨酸富集蛋白(Serine/arginie riched protein,SR protein)家族成员具有重要作用。SR蛋白的分子结构包含N末端的RNA结构域和C末端RS结构域,N末端的RNA结构域可以与mRNA前体相互作用。SR蛋白从核小斑转移到转录活化部位,结合mRNA前体,并招募多种剪接因子,介导mRNA前体加工。
Tripathi等通过RNA-FISH实验,使用MALAT1和U2-snRNA特异性探针和SR剪接因子抗体,证实核富集的MALAT1与丝氨酸精氨酸SR蛋白相互作用,影响剪接因子的配送等。沉默MALAT1或过表达SR蛋白可以不同程度的改变内源性前mRNA的选择性剪接。磷酸化是决定SR蛋白功能活化的重要步骤,研究还发现,MALAT1在细胞水平调节SR蛋白质的磷酸化和去磷酸化水平,从而控制其活性。Wang等发现,在GC细胞系,过表达SF2/ASF的核仁中,MALAT1异常高表达,当下调MALAT1表达时,SF2/ASF的核分布和表达显著受损,MALAT1可调控SF2/ASF的核内定位。
MALAT-1的调控与互作因子
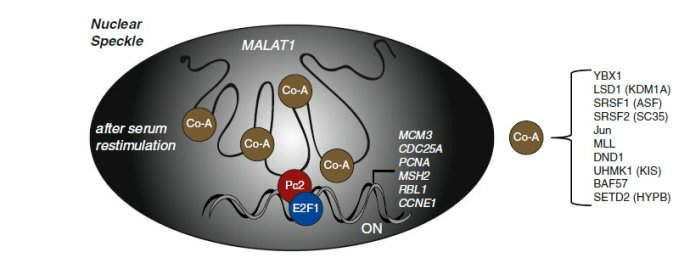
《MALAT1 -- a paradigm for long noncoding RNA function in cancer.》J Mol Med (Berl). 2013 Jul;91(7):791-801.
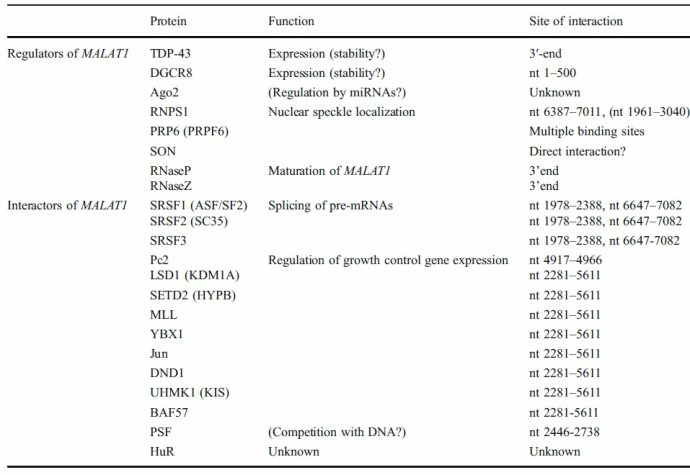
MALAT1 与肿瘤

《MALAT1 -- a paradigm for long noncoding RNA function in cancer.》J Mol Med (Berl). 2013 Jul;91(7):791-801.
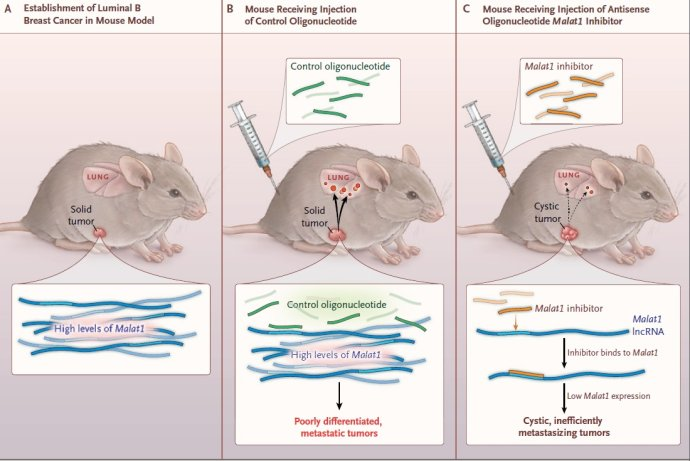
MALAT-1广泛表达于哺乳动物正常组织,并在诸多人类恶性肿瘤中异常表达,其异常表达改变了肿瘤细胞的生物学表型。虽然MALAT-1不直接编码蛋白,但其对肿瘤的增殖、凋亡、侵袭转移、耐药都有不同程度的影响,发挥重要作用。
MALAT1 Knock-out(KO)模型呈现争议表型
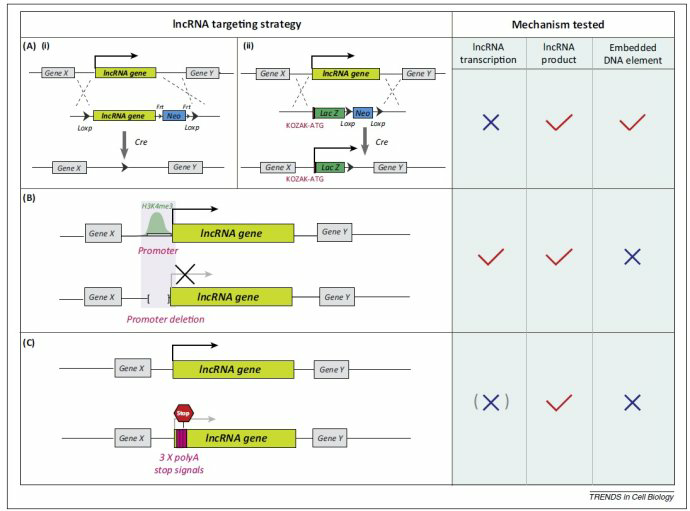
《Physiological roles of long noncoding RNAs: insight from knockout mice》Trends Cell Biol. 2014 Oct;24(10):594-602.
lncRNA遗传操作的策略主要有三种:
A. 完全缺失(i)或者替换(ii)
B.启动子缺失
C.提前终止
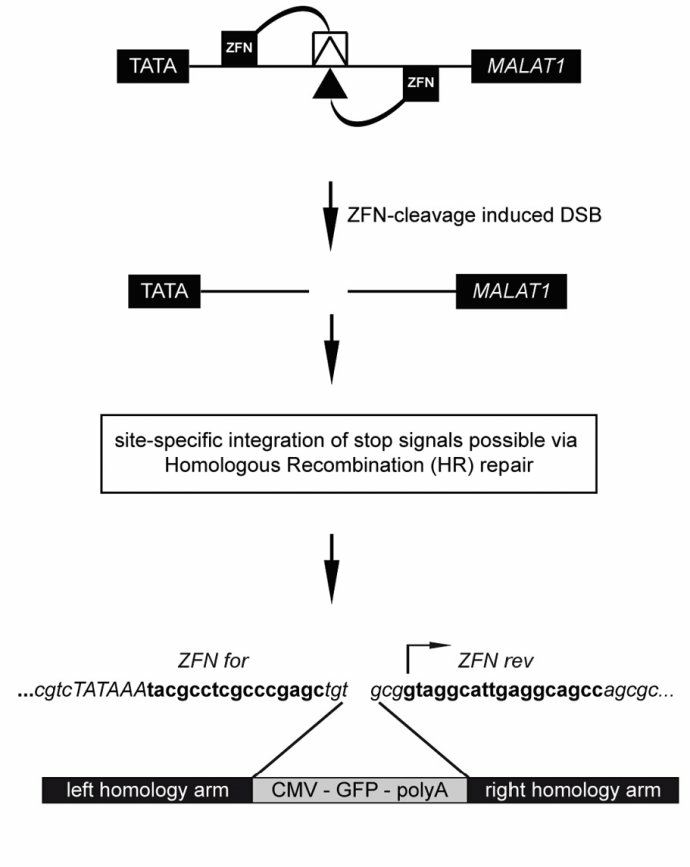
《Loss of the abundant nuclear non-coding RNA MALAT1 is compatible with life and development.》RNA Biol. 2012 Aug;9(8):1076-87.
ZFN:锌指核酸酶是由FokI限制性核酸内切酶当中的非特异性的DNA切割结构域和锌指蛋白(zinc-finger protein)组合而成的。ZFN二聚体(dimers)能够促使DNA断裂形成DSB,进而诱发DSB修复机制。锌指结构域的靶向功能使ZFN能够对基因组中的特定位点进行定向改造。在人类的肿瘤细胞以及小鼠中通过ZNF缺失MALAT-1并没有看见明显的表型效应。但是在大量研究中对MALAT-1 表达和机制研究发现了大量的表型效应,但是缺失却没有反应出来表型,这种矛盾表明MALAT-1对于生命和发育是非必须基因,但是在生理条件和具体的脏器和细胞中发挥的重要的调控角色,这种机制引起了大量有兴趣的话题!

- 发表于 2018-09-13 15:00
- 阅读 ( 32107 )
- 分类:默认分类
你可能感兴趣的文章
- 对方向扔了一个赤果果的生信分析SCI思路 9539 浏览
- miRNA与lncRNA的关系网络构建 13883 浏览
- 第三篇lncRNA signature的文章解析,IF五分胶质瘤 6233 浏览
- 两篇胃癌lncRNA signature文章解读之二(IF=3.2) 5806 浏览
- 两篇胃癌lncRNA signature文章解读之一(IF=7.7) 7728 浏览
- 人类lncRNA 简介 7228 浏览
相关问题
0 条评论
请先 登录 后评论
